引入
奈非那韦($Nelfinavir$),一种用于治疗艾滋病等严重疾病的上市药物,它和它的甲磺酸盐都是目前人类对抗 $HIV$ 的重要武器。其化学结构如下图所示:

人们提到它时,通常都会感叹其药效之神奇与强大,就连艾滋病这样的“不治之症”都败倒在它手下。但很少有人知道的是,奈非那韦是最早的被人类设计出来的药物之一,它让人类真正体会到了分子设计的力量。
现在,就让我们去看看这个药物是如何被一步步“设计”出来的,去领略分子设计这门学科中壮丽的风景。
正文
1.药物分子设计简介
传统的药物设计从总体上来讲,缺乏成熟完善的发现途径,具有很大的盲目性。比如各种中药,便是在“神农尝百草”中发现的;著名消炎药阿司匹林也是将天然产物水杨酸乙酰化后得到的,如下图:

这种方法有一个显然的问题,便是开发效率很低,很难迅速得到合适的新药来治疗越来越多的疑难杂症。随着计算机技术及计算化学、分子生物学和药物化学的发展,药物研发进入了新时代,药物分子设计也就应运而生。
口服药物在人体内大致会经过以下过程:吸收 $\to$ 分布 $\to$ 代谢 $\to$ 排泄,若是静脉注射则一般看成没有吸收过程。在吸收后,药物变成我们所讲的游离药物,它可以到达我们所希望的目的地,产生药效,治疗疾病;也有可能脱靶,产生我们不想要的副作用。最后药物被代谢排出体外,因此最后两步也被统称为消除。如下图所示:
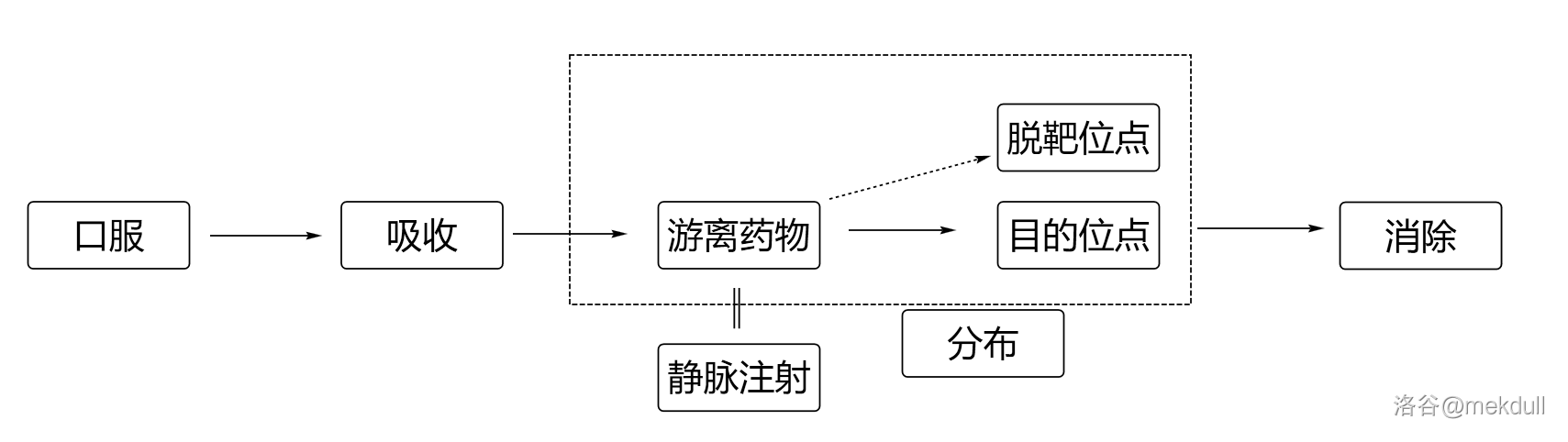
现代的药物设计要求不仅是药的效果好,副作用小也很重要。因此,我们就希望药物分子尽量不要脱靶,尽量全部赶到目的地发挥作用。那么,问题来了:靶是什么?
由于蛋白质是生命活动的主要承担者,所以药物分子一般最后都是通过影响特定蛋白质来影响生化过程。药物可以直接作用于特定蛋白质,激活或抑制之;也可以作用于 $DNA$、$RNA$、逆转录酶等,通过中心法则来间接影响蛋白质。中心法则的简单示意如下:
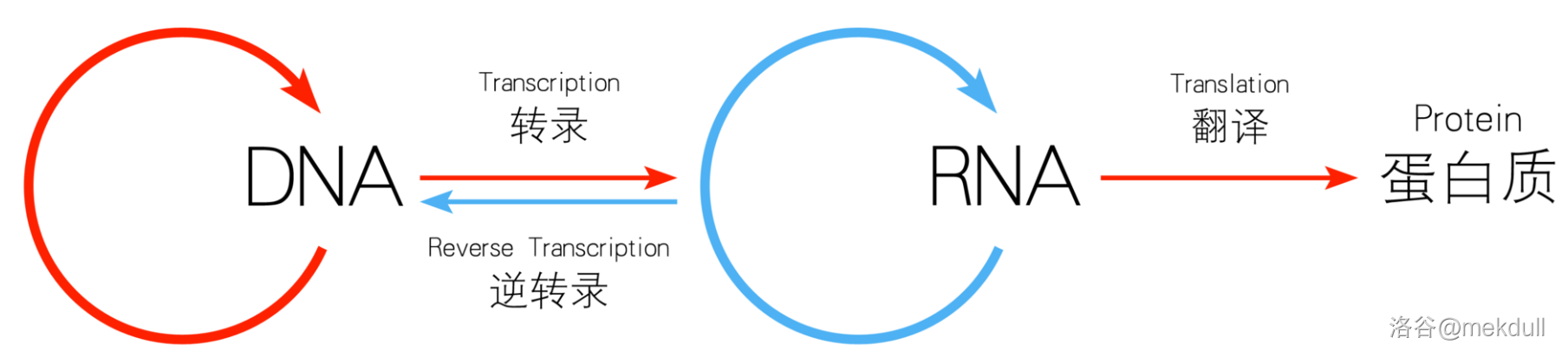
可见,影响其中任意一环皆可最后影响蛋白质。药物分子直接与之结合,产生作用的那个东西,就是我们所说的“靶”。
确定了靶之后,我们一般先需要得到一个所谓“先导化合物”,随后在优化这个先导化合物。先导化合物则可以从天然产物得到、从已知药物得到、从数据库筛选,当然也可以自己设计。但不管怎么样,解析靶点结构是必不可少的,只有这样才能确认所谓“结合口袋”。相当于你要配一把钥匙去开锁,你得先知道锁孔的结构,根据这个结构才能去设计、优化用来“开锁”的分子。
理论的东西差不多了,终于可以进入实例了:奈非那韦,究竟是被如何设计出来的?
2.奈非那韦的设计过程
首先,科学家们确定了药物的靶:HIV-1 蛋白酶,一种在艾滋病病毒成熟过程中起到至关重要作用的酶。如果能够抑制这个酶,病毒就没有办法成熟,也就丧失了其感染性。这个酶的结构如下,由两条相同的肽链构成,红色为 $\alpha$ 链,绿色则为 $\beta$ 链,每条链含有 $99$ 个氨基酸残基。

可以看到,两条链组成了一个中空的孔道,里面可以容纳底物。科学家在研究其反应机理时找到了两个至关重要的部位:一个是由两条链 $45-55$ 号氨基酸残基构成的“柔性区域”,而这个区域中间,两条链的 $48,49$ 号甘氨酸($Gly$)残基、$50$ 号异亮氨酸($Lle$)残基共同构成了一个“盖子”,如下图所示:
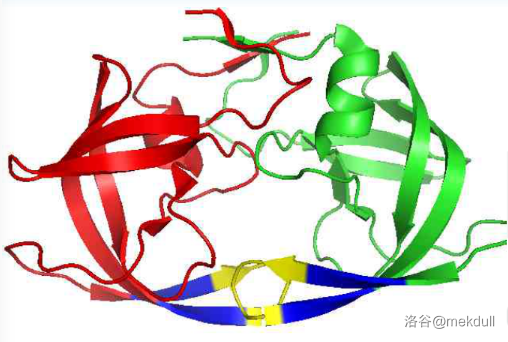
(图中:黄色部分为“盖子”,蓝色部分为“柔性区域”)
当没有底物与蛋白酶结合时,“盖子”处于开启状态;底物进入孔道后,“盖子”关闭开始反应;反应结束后,“盖子”打开,产物脱离酶。也就是说,这个结构起控制物质进出的作用。
另一个重要部位是这个酶的活性中心,处于两条肽链形成的一个“套环”结构上。如下图所示,蓝色部分即是:
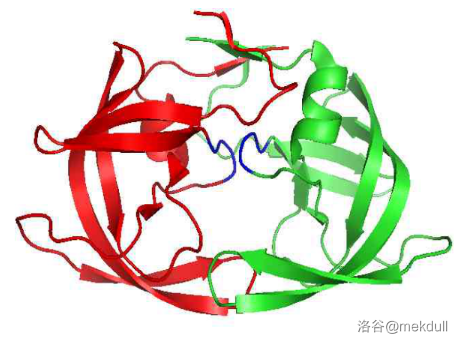
这一部分是由三个氨基酸残基构成的:$25$ 号位的 $Asp$(天冬氨酸残基)、$26$ 号位的 $Thr$(苏氨酸残基)与 $27$ 号位的 $Gly$(甘氨酸残基)。下图中用不同的颜色标出了不同的残基,其中黑线指向的天冬氨酸残基是酶真正作用的核心。
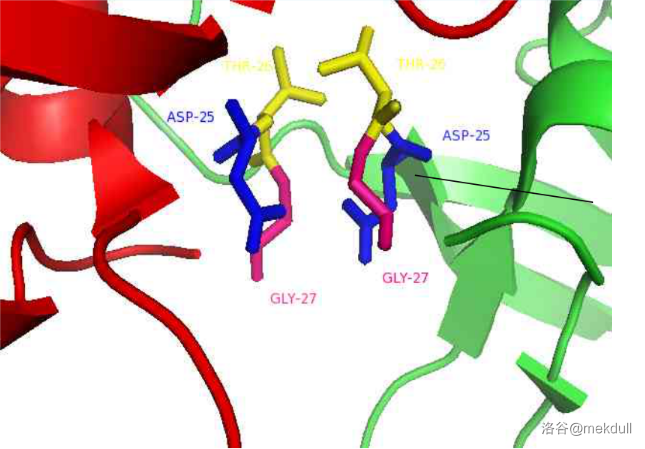
好,知道了这两个关键之后,我们只需要找一个分子,可以在“盖子”打开时进入酶的中空孔道,然后“卡住”酶的活性中心,不就能抑制这个酶了吗?专业一点,我们要根据其结构特点,设计一个可以竞争性结合 $HIV-1$ 蛋白酶的分子。
接下来便是先导化合物的设计。科学家从之前的一项研究中找到了灵感:氨基酸序列 $\cdots-Phe-Pro-\cdots$(即苯丙氨酸-脯氨酸)可以与 $HIV-1$ 蛋白酶结合,于是设计出了一个多肽化合物,作为先导化合物:

为了方便后续讨论,我们画出这个分子的完整结构,然后把它分成 $4$ 个部分并编号,如下图所示:
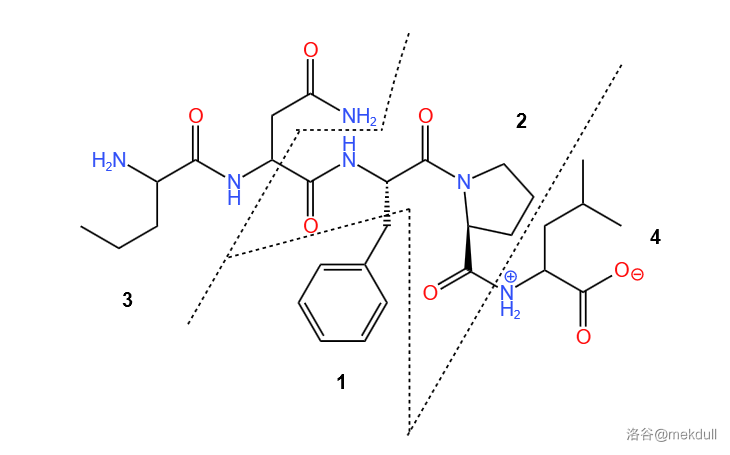
随后,科学家们便开始研究这段序列为什么可以与酶结合。研究发现,分子中 $2$ 号部分有 $3$ 个氧原子,其中两个与酶“盖子”结构上结合的那个水分子产生氢键作用,另一个与酶肽链的端基也产生氢键作用,从而使其被识别,如下图:
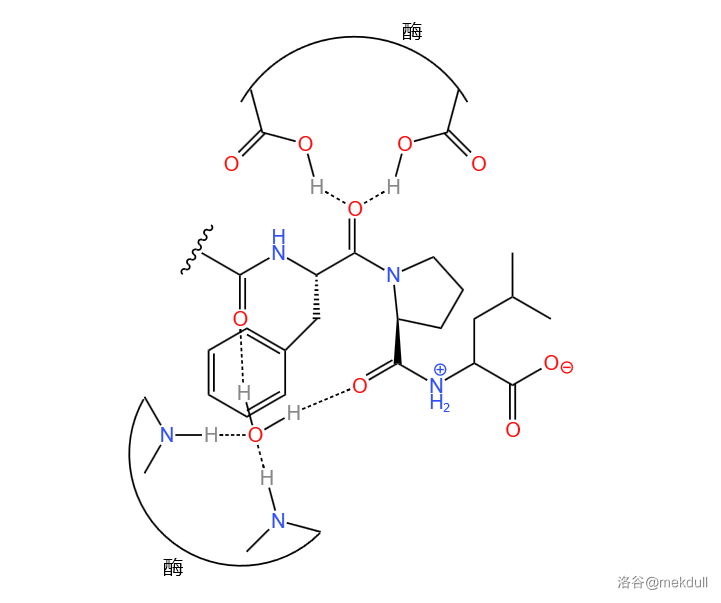
知道了关键点以后,科学家们就开始着手优化这个先导化合物。首先一点是,$2$ 号部分中的那个四氢吡咯环(下图中方框框出的部分)没什么用而且空间位阻超大,阻碍了与酶的结合;同时 $2$ 号部分一个碳原子(下图中虚线圈出的碳原子)手性固定,无法旋转,使分子不灵活而阻碍了与酶的结合。基于这两点,科学家们对分子进行优化,把四氢吡咯环换成了苯环。同时,科学家还把 $2$ 号部分中一个羰基换成羟基,使其构型固定,可以让它更好地与酶产生氢键作用。最后,科学家们还稍稍简化了 $4$ 号部分的结构,总体如下图所示:
接着,科学家开始设计 $3$ 号部分的结构。如果直接把这个部分去掉,得到的分子药效并不好,那么显然 $3$ 号部分的结构也有一定作用。
最终,科学家们参考了另一种 $HIV-1$ 蛋白酶抑制剂 $Roche$ 的结构。这种参考成功案例结构的方法在现代药物的研发中可谓家常便饭,很多情况下,得当的参考可以大大减小研发难度与时间。$Roche$ 本体的结构如下图所示:
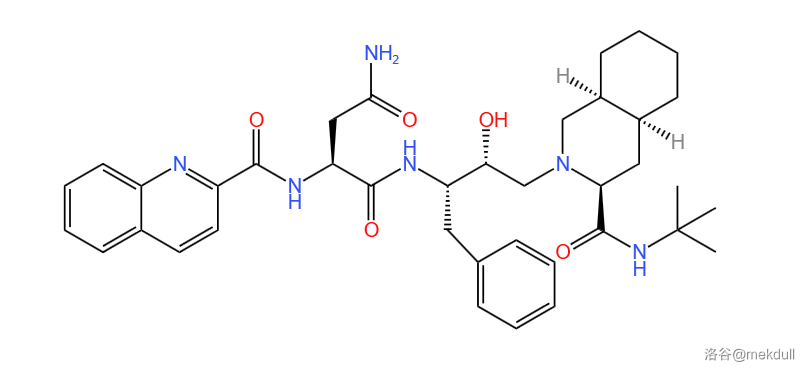
借用这个分子左侧的喹啉结构后,便得到了一种编号为 $LY289612$ 的化合物,也是第二个先导化合物。其结构如下:(说实话,$LY289612$ 与 $Roche$ 的分子结构已经非常相近了,所以后来有人说不如直接拿 $Roche$ 作为先导化合物)
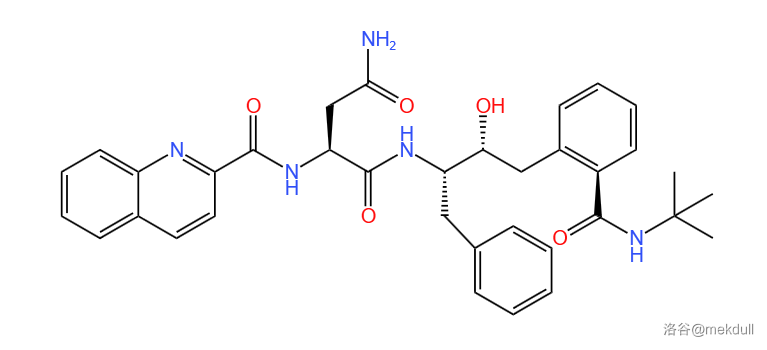
但问题还是没有解决,这种化合物的药效仍然不理想!于是,科学家们又对 $LY289612$ 与 $HIV-1$ 蛋白酶的复合体的结构进行了分析。他们发现 $LY289612$ 中 $1$ 号部分中的苯环与 $3$ 号部分的喹啉环在空间位置上非常靠近。我在自己的计算机上渲染了这个分子的立体结构,也发现确实有一种构型会使得这两个部分靠得特别近,如下图:
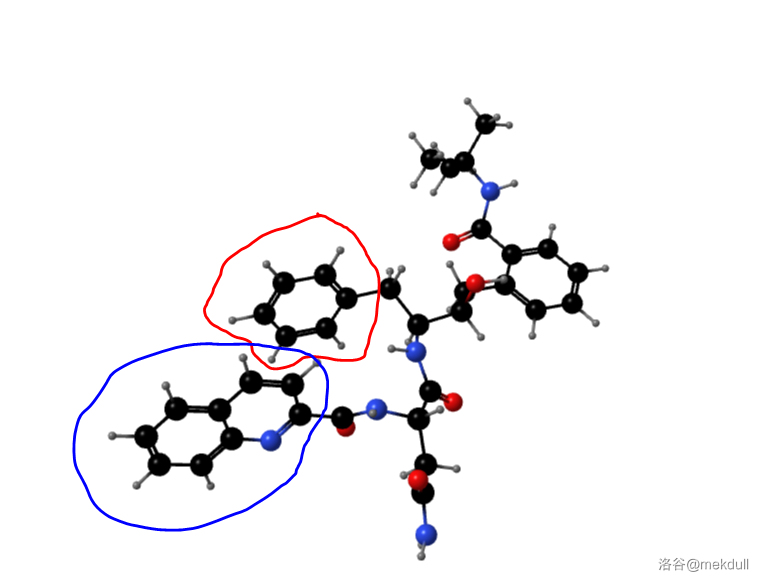
(上图:红笔圈出的是 $1$ 号部分的苯环,蓝笔圈出的是 $3$ 号部分的喹啉环)
此前的研究表明:$3$ 号部分在与蛋白酶结合的时候被塞进了酶中一个类似于口袋的结构里,而 $1$ 号部分没有。科学家们便猜想:药效不理想的原因是1号部分的苯环没有被塞进理想的位置,导致了药物分子与靶的结合力变低。解决方法便是:把 $1$ 号部分的苯环塞进原本装着 $3$ 号部分的口袋。
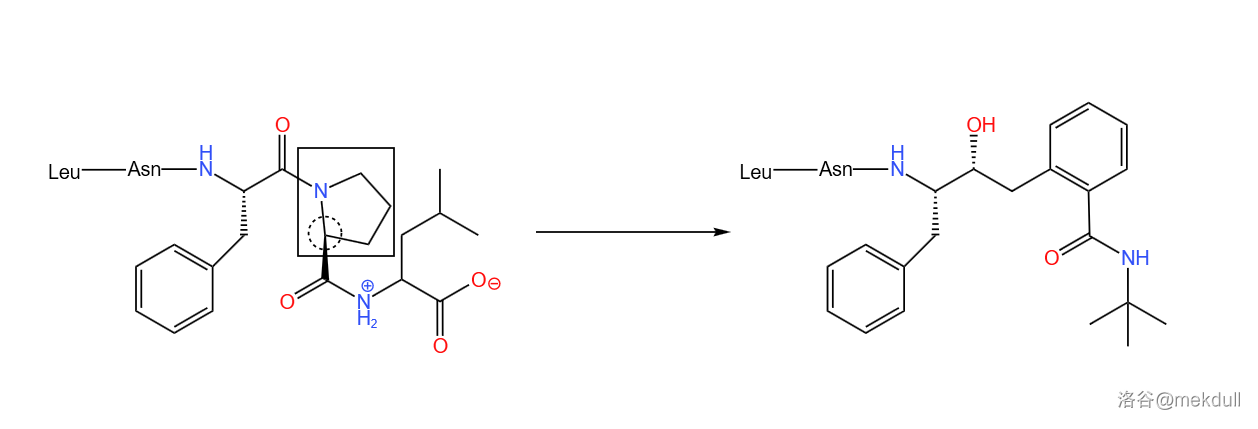
随后便是分子优化。在 $1$ 号部分加一个硫原子,使得链变长而得以伸进口袋;把 $3$ 号部分变小,防止它占用口袋太多的容积导致 $1$ 号部分塞不下。如下图所示,请特别注意被虚线框框起的部分前后的改变:
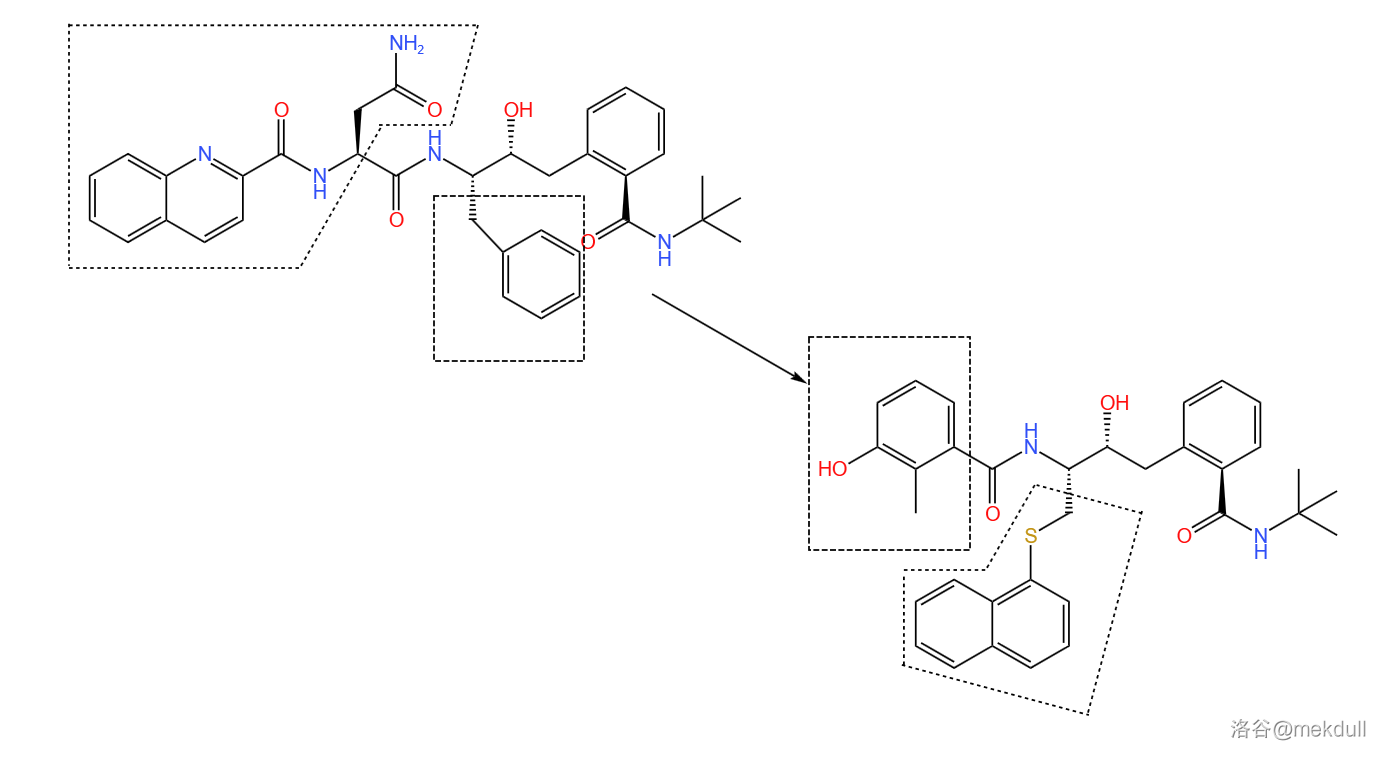
经过测试,这种物质(编号为 $AG1254$)效果不错,但问题又来了:这种物质水溶性不好,难以被身体吸收。那么,即使它药效再好,也难有展现实力的机会。
那么怎么办?很简单,缩小疏水基团。首先把 $1$ 号部分的那个萘环改成苯环,然后再把 $2$ 号部分的那个苯环改成 $Roche$ 结构中的氢化异喹啉环。如下图所示:
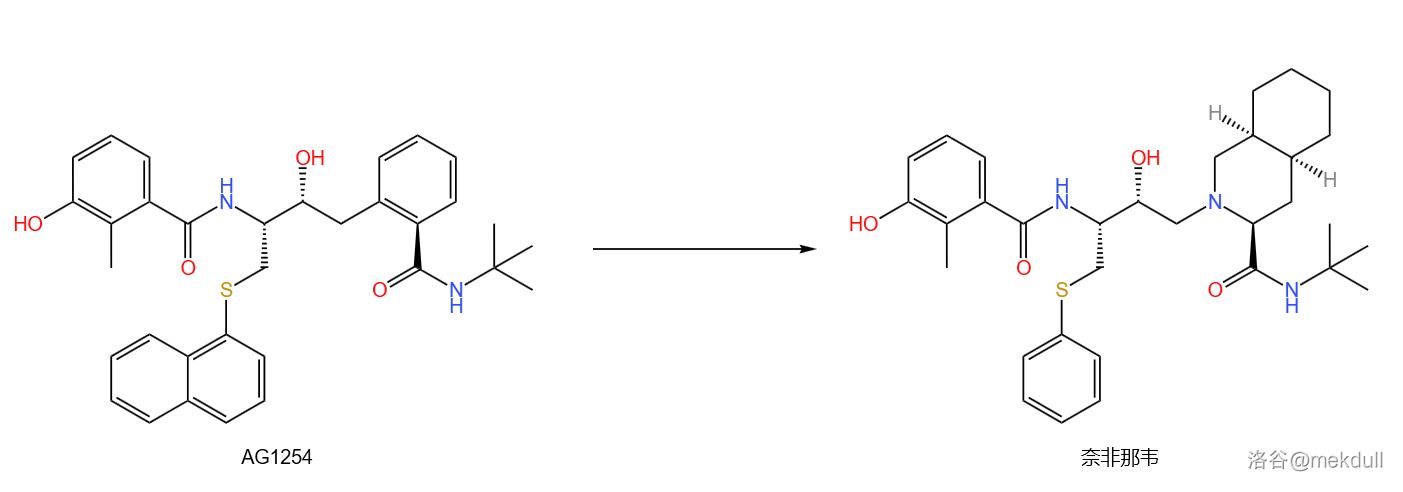
在这一步结束后,我们终于得到了可以有效抑制 $HIV-1$ 蛋白酶的药物——奈非那韦。
有人会问,把苯环改成氢化异喹啉环,那么空间位阻不是又大了吗?构型不是又固定而不能旋转了吗?但事实表明,奈非那韦仍然可以很好地与 $HIV-1$ 蛋白酶结合,说明这里的大空间位阻其实可能并没有什么大影响。我们或许是走了一些弯路,但我们最终还是到达了终点。
总结
奈非那韦的成功是现代药物分子设计的里程碑。它不出所料地击败了效果不及它的 $Roche$,成为了人类对抗艾滋病的一把利剑。
回首它的设计历程,我们会不禁感慨现代分子设计的伟大力量。将一系列似乎微不足道的简单结构拼接在一起,居然就能得到治病的良药,这也让我们不得不感叹化学与生物的奇妙。分子设计让新药研发不再是大海捞针,也不再局限于对天然产物的改良,而是可以将分子设计成我们想要的模样。相信在不远的未来,随着化学的进步,我们一定可以设计出更加美妙的物质,甚至是让这项技术走入千家万户,大放异彩。人类古老的梦想,即一个理论设计物质的时代正在成为现实!