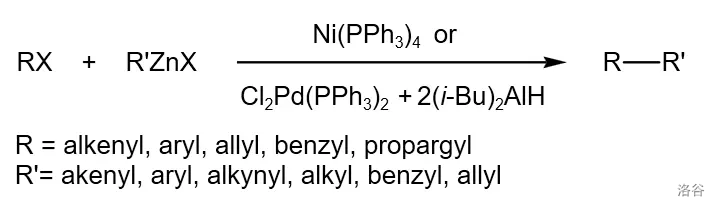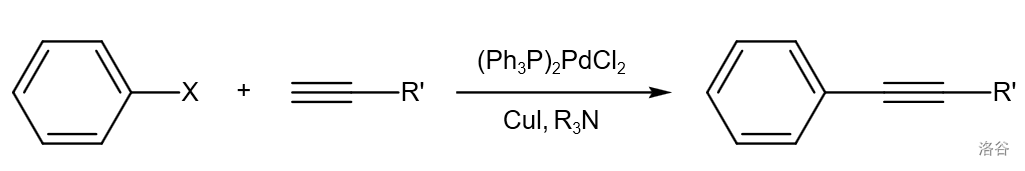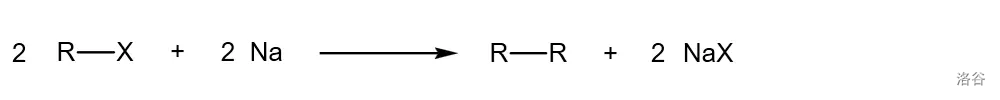前言
偶联反应,又名耦合反应、偶合反应、耦联反应,是有机化学中的一类重要反应。广义的偶联反应是指将两个或以上的有机单位连为一体的反应,按此定义,酯化反应、醚化反应等都可以归为此类。而狭义的偶联反应指有机金属化合物、重氮化合物等物种参与或催化的 或 成键反应。
可以看出,偶联反应的定义并不十分明确,且与缩合反应的定义由很大的重叠,但我们也必须承认,偶联反应无疑是有机合成中最重要的反应之一,且至今依然活跃。
这篇文章汇总了 个非常重要的偶联反应。由于定义问题,这里只收录了“典型”的偶联反应(主要参考了《》和《基础有机化学》(北大邢其毅版)的意见,这些反应基本都符合狭义定义。没有包括烯烃复分解反应)。反应按照首字母排序,并标注其发现年份;文中大多数反应都会包含有它的基本形式、机理与实例。
正文
1.Barbier 偶联反应(1899)
在 或它们的盐存在下,烷基卤化物作为亲电体与醛(酮)发生的偶联反应:

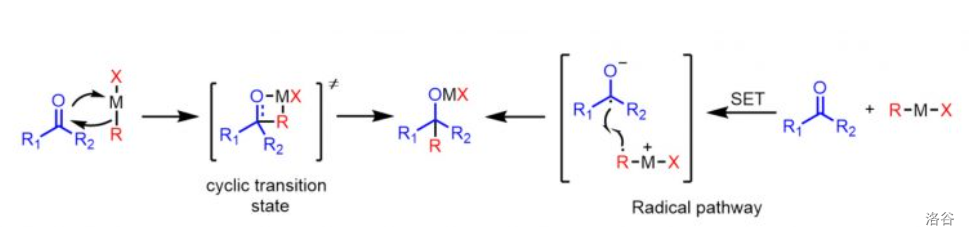
巴比耶()被认为是有机金属化学的奠基人之一,它同时也是格林雅()的老师。 反应在有机合成的历史上意义重大,且至今仍在广泛使用。
传统认为反应会经历一个四元环的过渡态,但近来也有人提出反应应是单电子转移()机理:
反应实例:
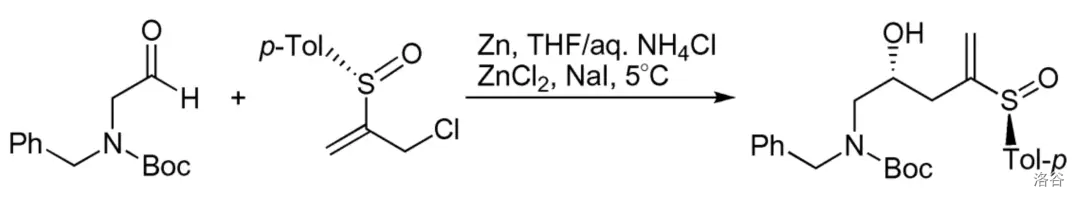
2.Bennett-Castedo 芳炔聚合偶联(1993)
芳炔过渡金属配合物(一般是 或 配合物)发生的聚合偶联反应。这个反应可以用来构筑苯环:
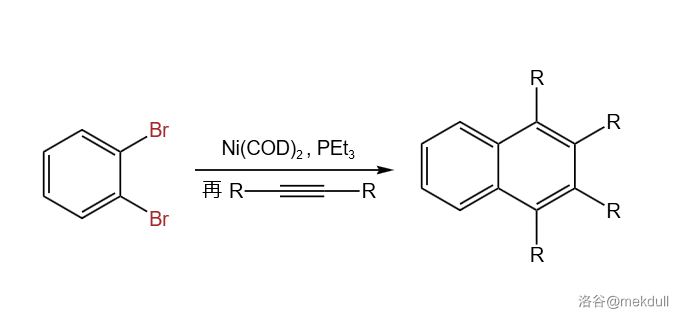
如果不加入炔烃,芳炔可以在催化下自发三聚,构建稠环芳烃异䓛的骨架( 异䓛合成反应)。反应实例:
3.Burke 硼酸酯偶联(2007)
硼酸酯是一种四配位的硼酸酯,使用温和的水相碱可以放出对应的硼酸。 硼酸酯可以作为稳定的合成砌块用于 偶联反应等各种偶联反应:
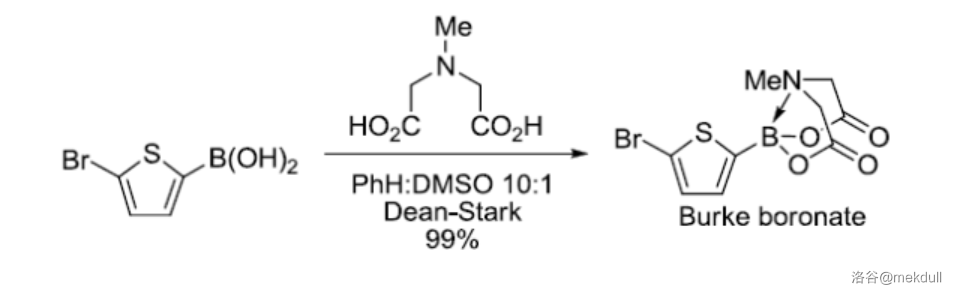
(上图: 硼酸酯的制备)
反应实例:
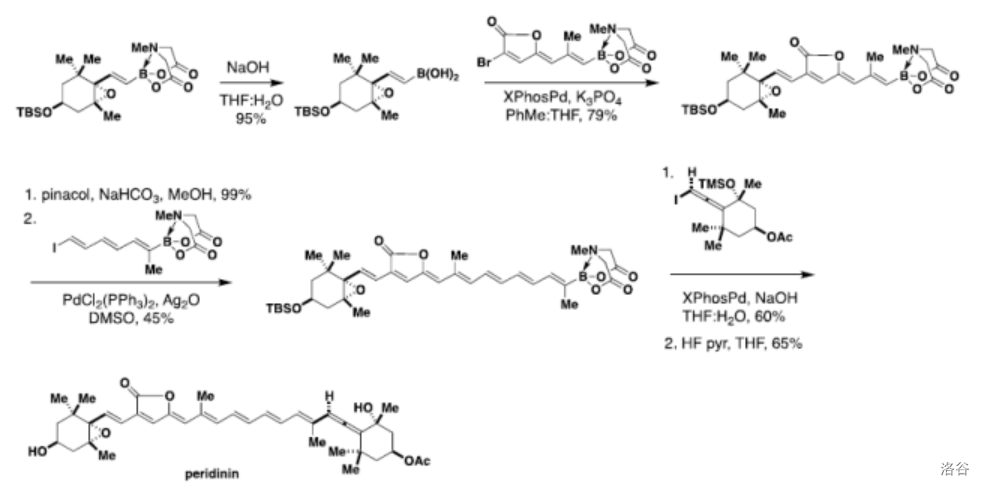
(上图:在天然产物 的合成中,多次使用了 硼酸酯的偶联)
4.Buchwald-Hartwig 偶联反应(1994)
在 催化下,胺类化合物(一般不能是三级胺)与芳基卤化物发生偶联反应。在类似的反应条件下,醇也可以代替胺进行反应,得到芳基醚。
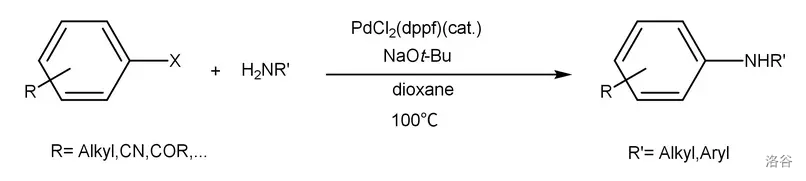
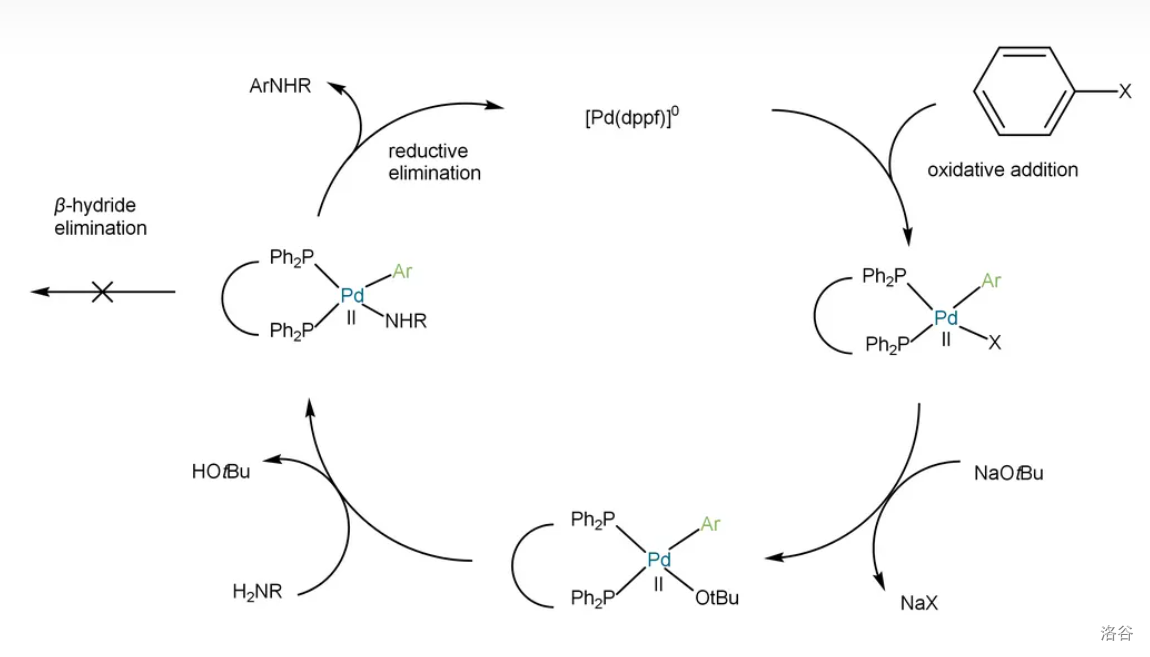
反应机理:
反应实例:
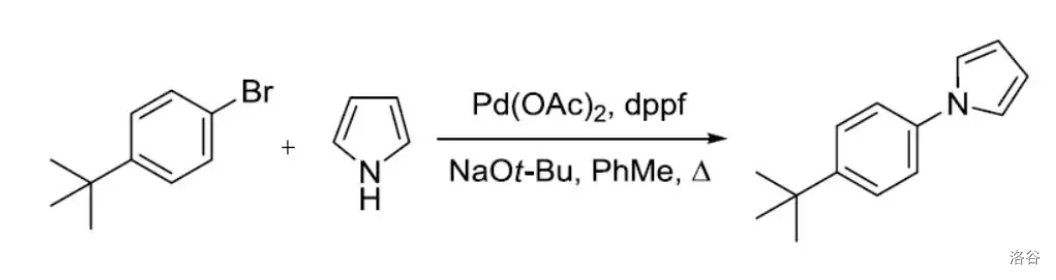
5.Cadiot-Chodkiewicz 偶联反应(1957)
在一价铜盐和碱(一般用脂肪族胺)存在下,溴代炔和端炔发生的交叉偶联反应:
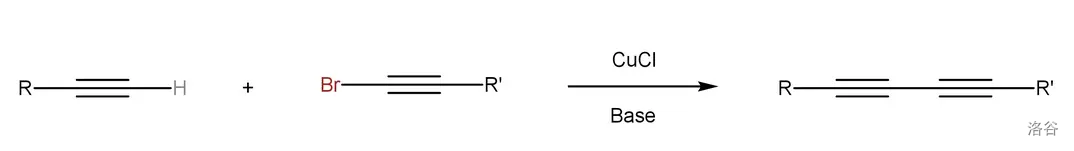
这个反应存在一些缺陷,比如反应对底物敏感、容易自偶联、产物难以分离等,但是作为第一个有效的过渡金属催化的 偶联反应,它拉开了合成非对称共轭二炔化合物的序幕。目前,已出现很多对此反应的改进。
反应机理:
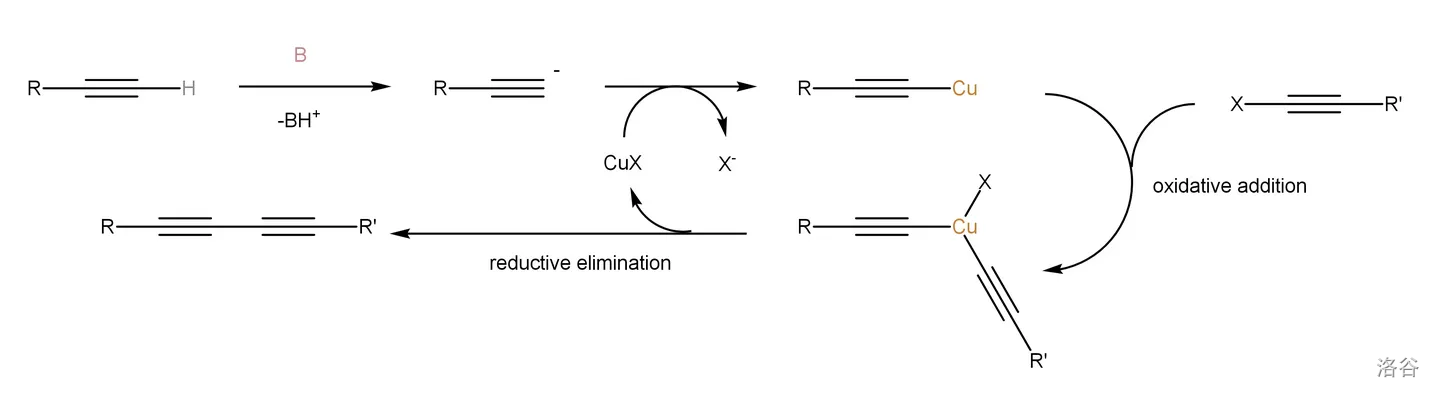
反应实例:

(勘误:第二个箭头上方的反应物左侧的甲基应为溴原子,在此纠正)
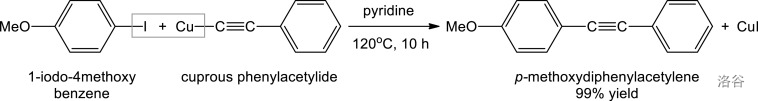
6.Castro-Stephens 偶联反应(1963)
炔酮()与 卤化物在碱作用下发生的偶联反应,经常用于芳基炔烃的制备:
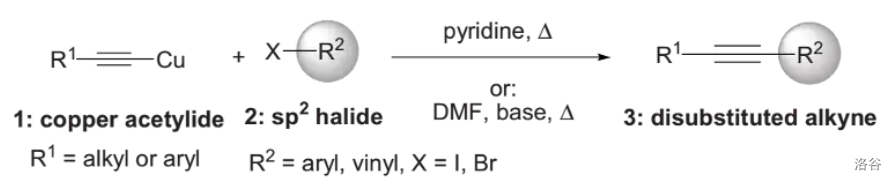
反应的缺陷是需要使用化学计量的 ,但它的改进法 偶联反应只需要用到催化量的 ,将在下文中详述。
反应机理:
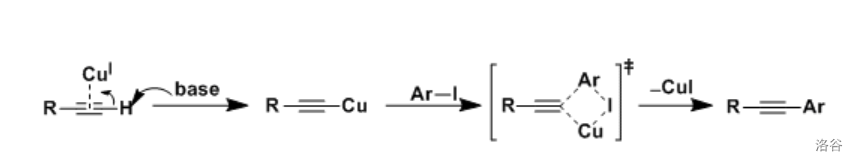
反应实例:
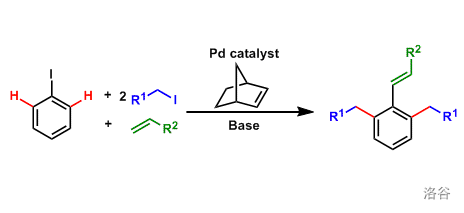
7.Catellani 反应(1997)
反应是一个著名的 键活化的多组分偶联反应。在降冰片烯与 共同催化作用下,芳基碘与烷基碘化物、烯烃发生偶联:
反应机理:

反应实例:

8.Chan-Lam 偶联反应(1998)
在乙酸铜()和碱的催化作用下,各种带 的底物与芳基硼酸(酯)在室温下、空气中发生的氧化交叉偶联反应。其条件比 偶联反应更为温和。近年来,也有一些改进使得该反应可以用于 键的偶联。(从应用性和普适性看,该反应已丝毫不亚于 交叉偶联反应。——《有机人名反应》语)

反应机理:(只给出了 键偶联的机理)

反应实例 ( 键的偶联):

反应实例 ( 键的偶联):
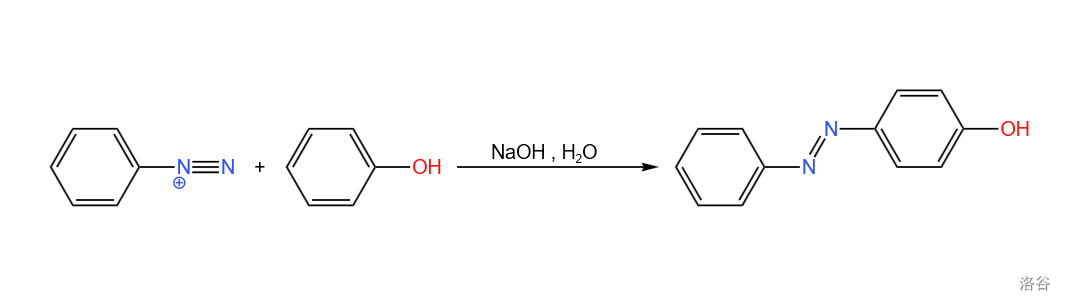
9.重氮盐偶联(1909)
有些时候会称为 偶联反应。重氮盐阳离子作为弱的亲电试剂与活泼芳香化合物进行的偶联反应:
反应机理:
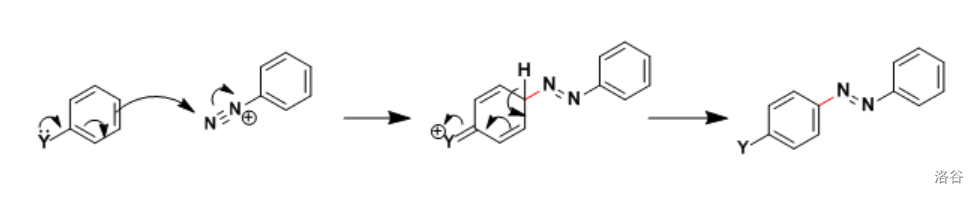
作为最经典的偶联反应之一,这个历史悠久的反应至今仍然在染料工业中发挥着及其重要的作用。如百浪多息(世界上第一种商品化合成的抗菌药物,前身是一种染料)的合成:

10.Corey-House 合成法(1967)
二烃基铜锂()试剂(又名吉尔曼试剂)与卤代烃或羰基化合物的偶联反应。这个反应可以有效地构筑 碳碳键:
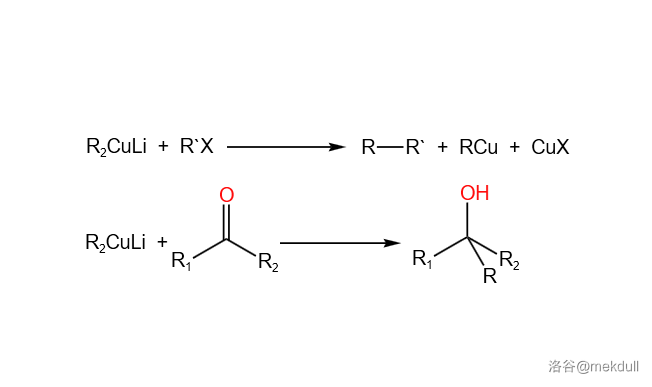
反应一般需要在较低温度下进行,选择性高。此外,它也可以与酰氯反应,得到酮。二烃基铜锂试剂本身可以用烷基锂试剂与卤化亚铜的反应制得:
反应实例:

11.Corey-Seebach 反应(1965)
被丙二硫醇()保护的羰基在强碱作用下被拔去氢离子形成碳负离子,随后与亲电试剂(醛、酮、卤代烷等)偶联:
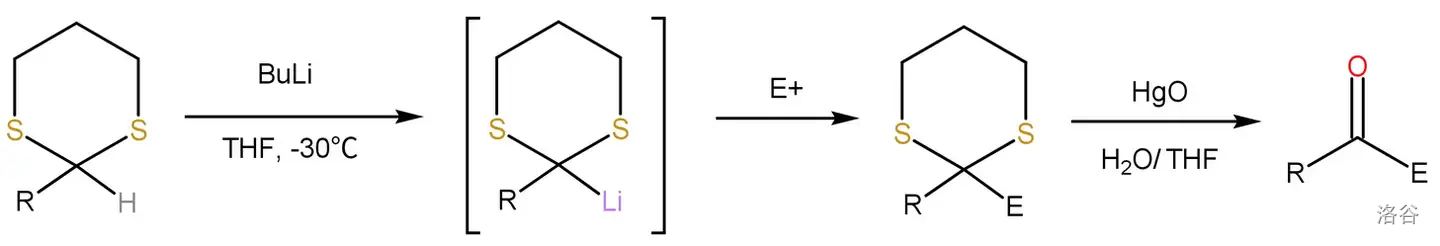
反应是一个极性反转的过程,机理在此略去。反应实例:

12.Dörz 反应(1975)
炔与烯丙基烷氧基铬卡宾配合物(又称Fischer卡宾)反应得到 配位的氢醌:
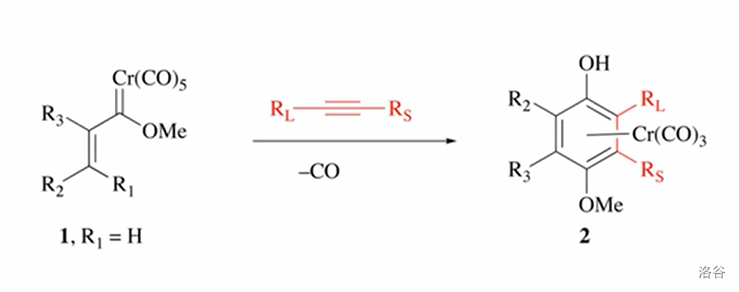
反应机理:
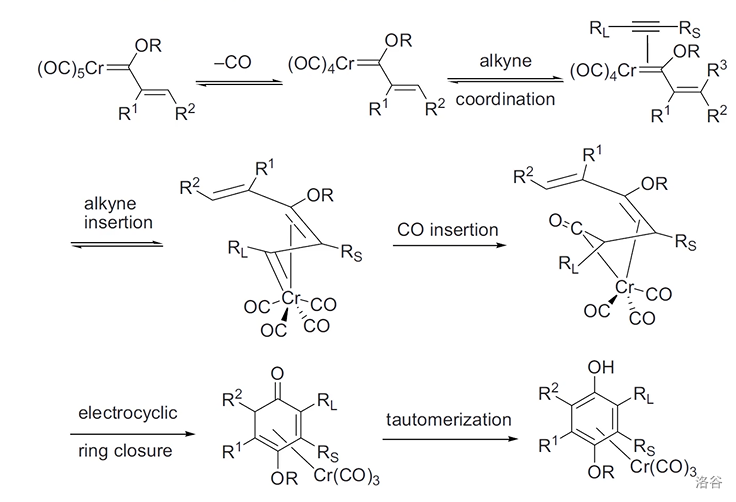
反应实例:
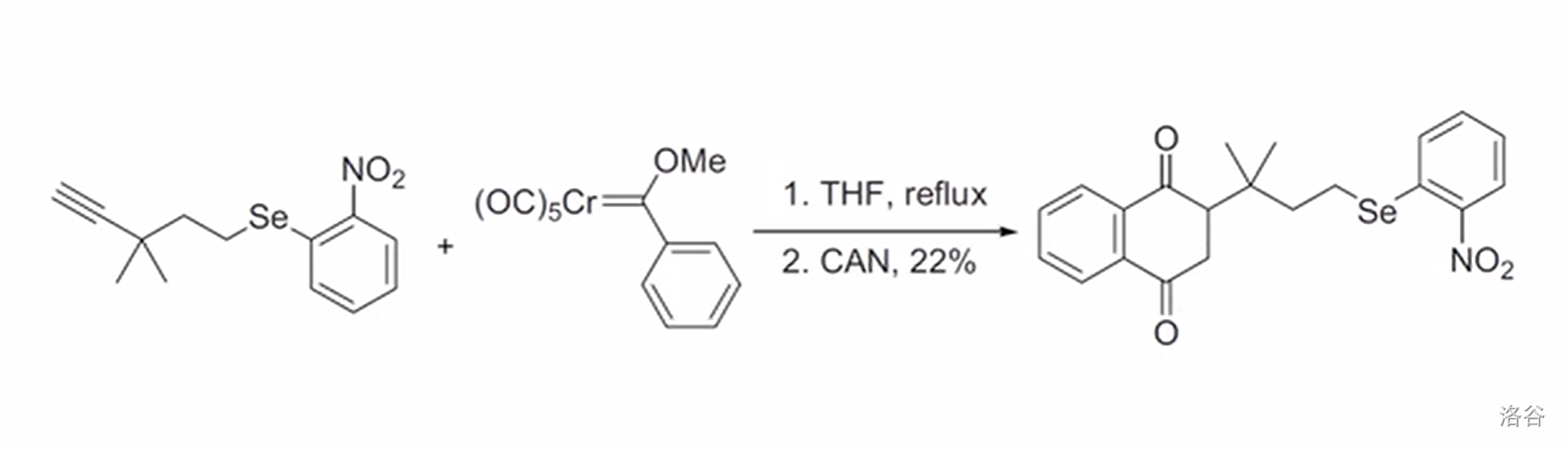
13.Eglinton 反应(1956)
端基炔烃在过量的乙酸铜()促进下氧化偶联:
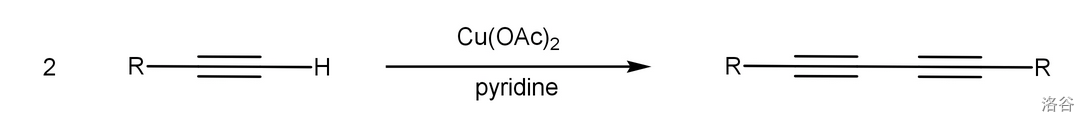
该反应是下文中 偶联反应的变异。近年来,一些对此反应的改进使得它也可以合成不对称的二炔类化合物。
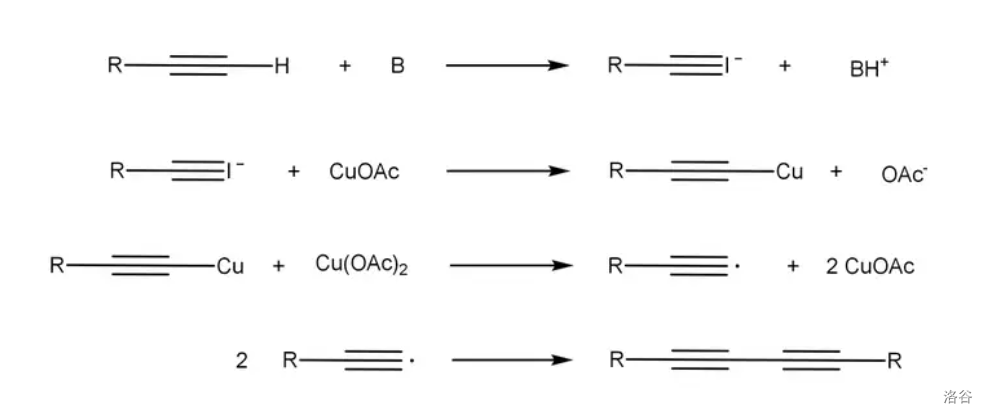
反应机理如下,是自由基历程:
反应实例:
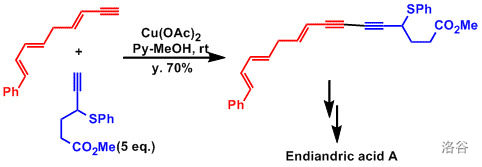
14.Friedel-Crafts 反应(1877)
中文一般简称为傅-克反应,是一个非常经典、有用的反应,主要分为两类:烷基化反应和酰基化反应。
14.1 Friedel-Crafts 烷基化反应
在路易斯酸(如 )的催化下,卤代烃可以对一个芳环进行烷基化:

反应经历碳正离子中间体(具体机理略去),因此可能会导致重排。烯烃也可以代替卤代烷进行反应。反应实例:

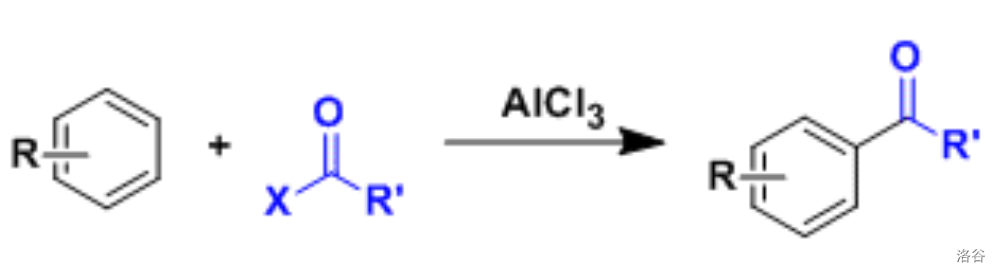
14.2 Friedel-Crafts 酰基化反应
在路易斯酸存在的条件下,酰卤或者酸酐作为酰化剂对芳香化合物进行的酰基化反应:
反应实例:
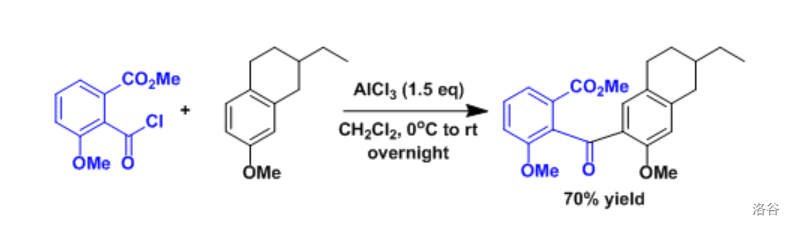
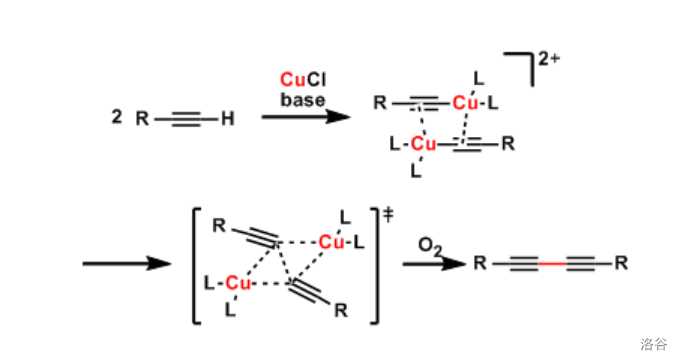
15.Glaser 偶联反应(1869)
又称为 偶联反应,指两分子端基炔烃在氧气气氛下由 物种催化的氧化偶联反应:

作为最早的偶联反应之一, 反应原本只能用于制备对称二炔。但是,最近的一些改进使其可以用于合成不对称的二炔,从而可以代替著名的 反应。此外,上文中提到的 反应是该反应的变异。
反应机理:
反应实例:
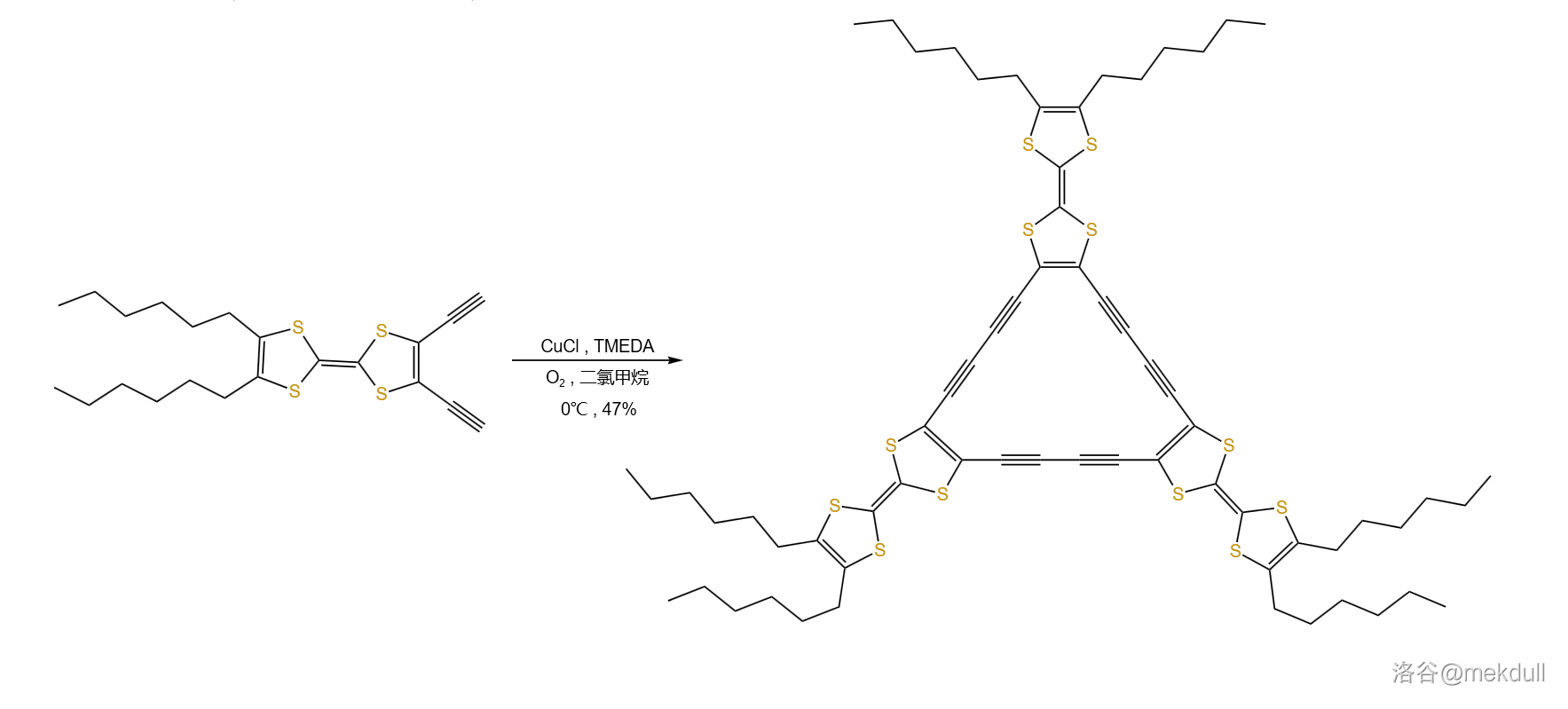
16.Gomberg-Bachmann 偶联反应(1924)
重氮盐和芳烃在碱或 物种催化下发生的自由基偶联反应:

一种自由基历程的反应机理:
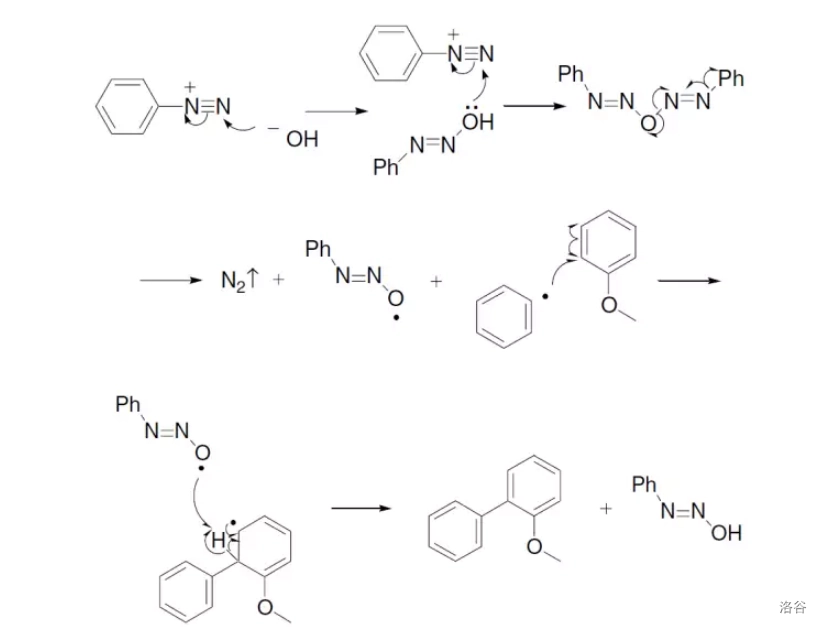
在 催化的偶联反应被发现之前,该反应是非常重要的 键构筑反应。分子内的 偶联反应被称为 反应,类似的还有 芳基化反应等,将在下文介绍。
反应实例:

17.Grignard 偶联反应(1900)
有机镁试剂(格氏试剂)对亲电物种的加成反应:

反应机理一般由两种:环状过渡态机理与单电子转移()机理。目前看来,两种机理均是可行的:

这个反应的重要性和著名程度无需多言。反应实例:
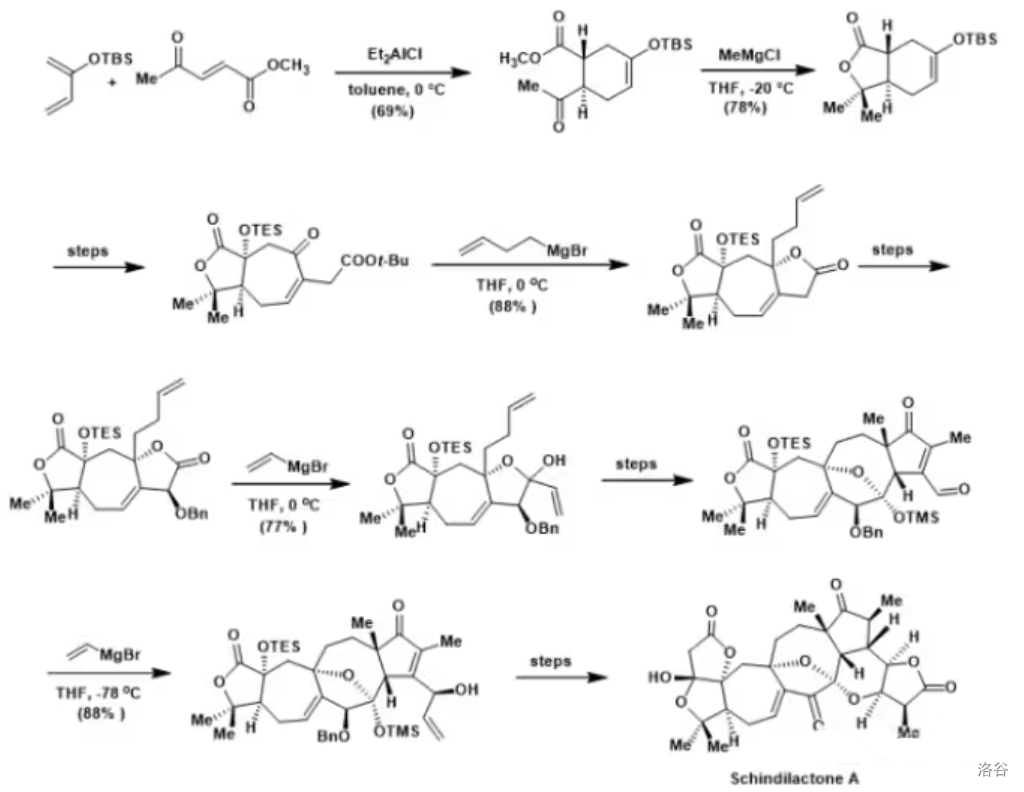
(上图:在 的全合成中,多次使用了格式偶联反应)
18.Heck 反应(1968)
又被称为 反应,是烯烃与芳基或乙烯基卤化物(或三氟甲磺酸酯)在 催化下的交叉偶联反应:

这个反应是目前有机化学中应用最为广泛的 键偶联反应之一,也是极具代表性的 催化的偶联反应。 也凭借这一反应获得了 年的诺贝尔化学奖。反应机理如下:

反应实例:

(上图:在 的全合成中, 反应是重要的一步)
年,出现了一种使用芳香重氮盐代替卤代烃进行的 反应,称为 反应,在此不作详述。
19.Hegedus 吲哚合成反应(1976)
在 催化下直接环化偶联邻烯(丙)基苯胺得到吲哚的反应:

反应机理:
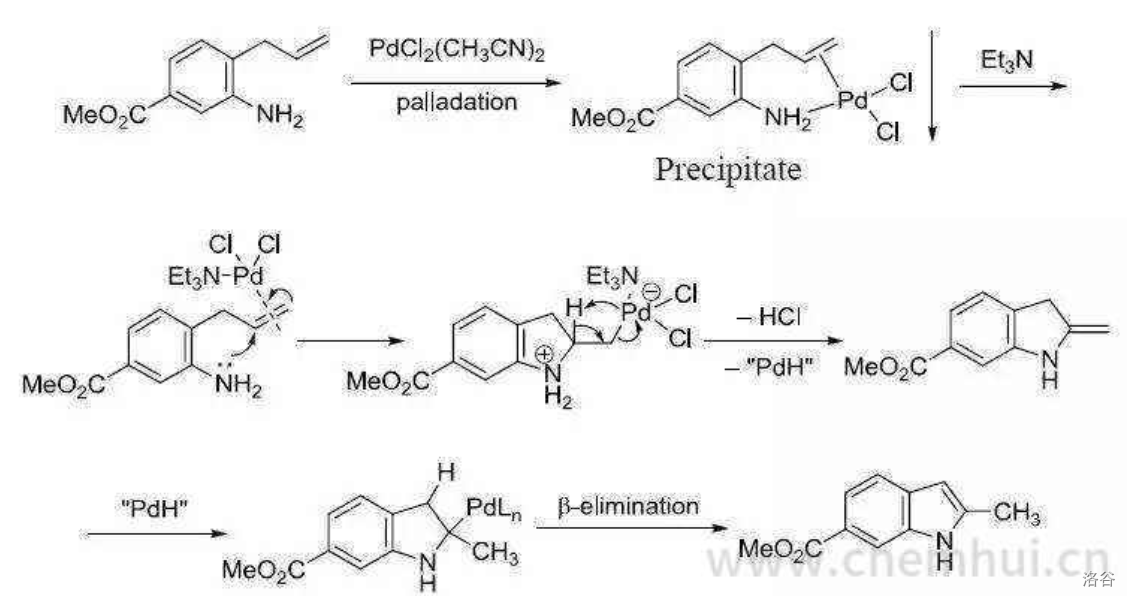
反应实例:
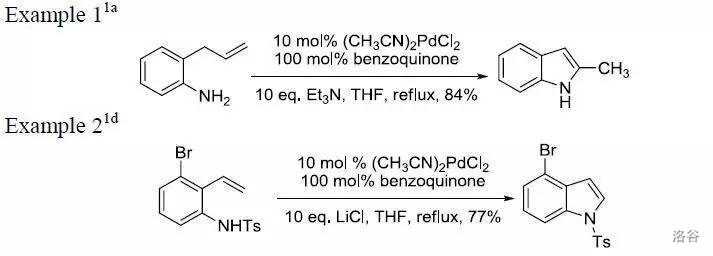
20.Hiyama 交叉偶联反应(1990)
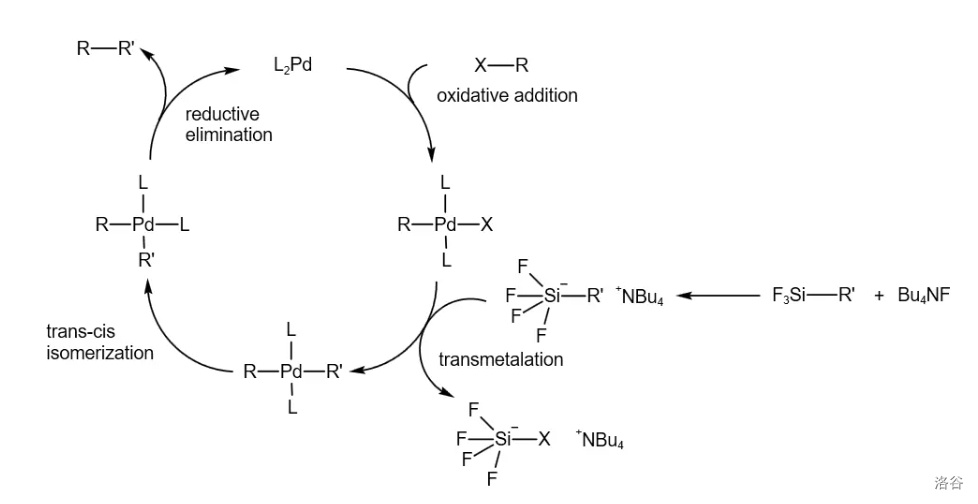
五大 催化的交叉偶联反应之一,是芳基、烯基、烷基卤化物或三氟甲磺酸酯等与有机硅烷之间的交叉偶联反应。反应一般需要 等活化剂参与:

(注:指 个重要且机理类似的的 催化的卤代烃与有机金属化合物或有机硼、有机硅的交叉偶联反应)
反应机理:
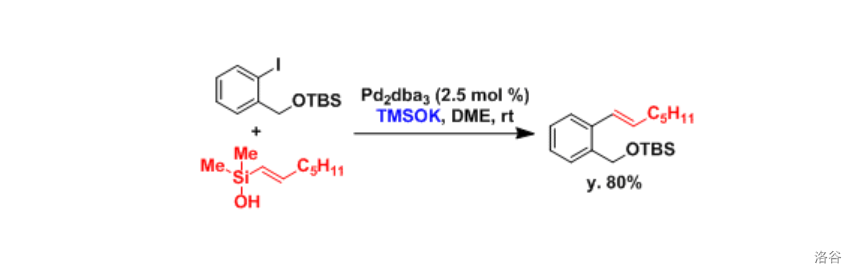
反应实例:
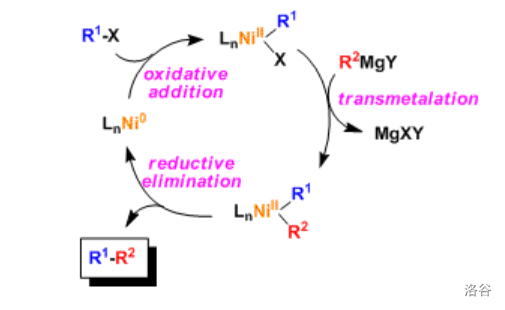
21.Kumada 交叉偶联反应(1972)
又称 交叉偶联反应,是五大 催化的交叉偶联反应之一,也是最早的 催化的交叉偶联反应之一。 交叉偶联反应指有机镁试剂(格式试剂)在 催化下与卤代烃发生的偶联反应:

反应机理:(此处给出的是 催化的 反应机理, 催化的类似)
反应实例:
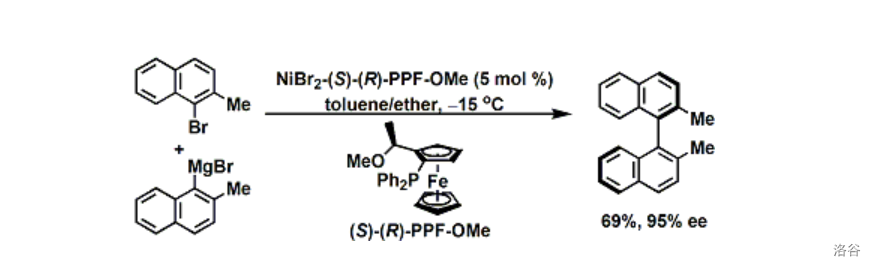
22.Larock 吲哚合成反应(1991)
在 催化下 碘苯胺(或其衍生物)与炔烃经偶联反应生成吲哚的反应,是目前合成吲哚衍生物的重要手段之一:
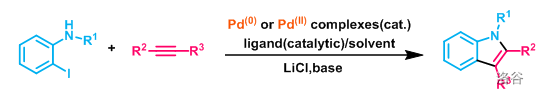
反应一般会使用等量的 和过量的碱来辅助催化。机理如下:

反应实例:

(上图:在 的全合成中, 吲哚合成反应是关键一步)
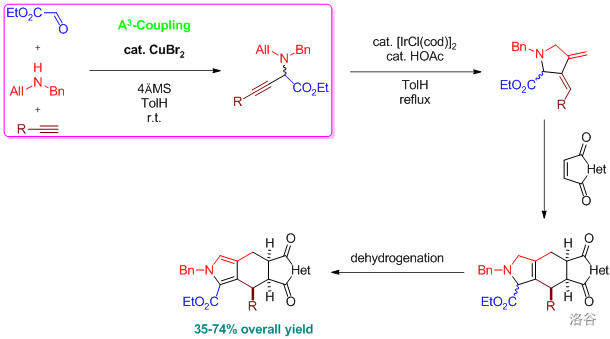
23.Li A 偶联反应(2004)
偶联反应是指醛、炔、胺在各类过渡金属催化剂(如 等)作用下的直接脱水偶联生成炔丙胺的反应:
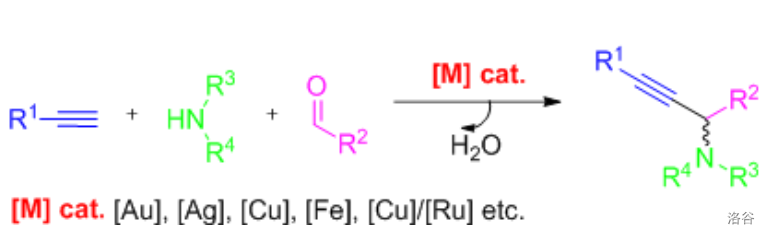
该反应条件温和,原子利用率高,副产物只有水。而且,与另一种构建炔丙基化合物的重要方法 偶联(详见下文)相比,可有效地避免使用极毒的 。反应中,重金属催化剂均采用催化量,因而对环境更为友好。
反应机理:

反应实例:
24.McMurry 偶联反应(1974)
醛(酮)在低价 物种的还原下偶联得到烯烃的反应,也是一个重要且经典的偶联反应。分子内的 偶联反应经常用于制备有环烯结构的物质。
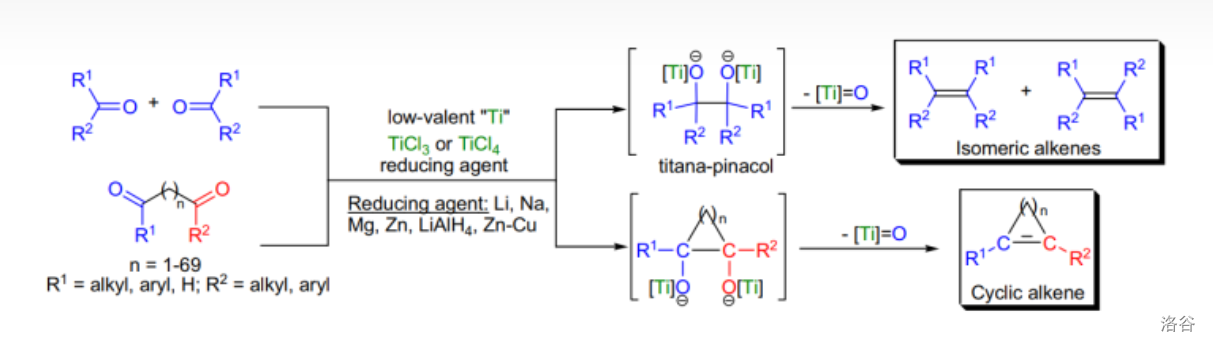
另一种将羰基化合物还原偶联为邻二醇的偶联反应称为频哪醇偶联,将在下文详述。
反应机理:
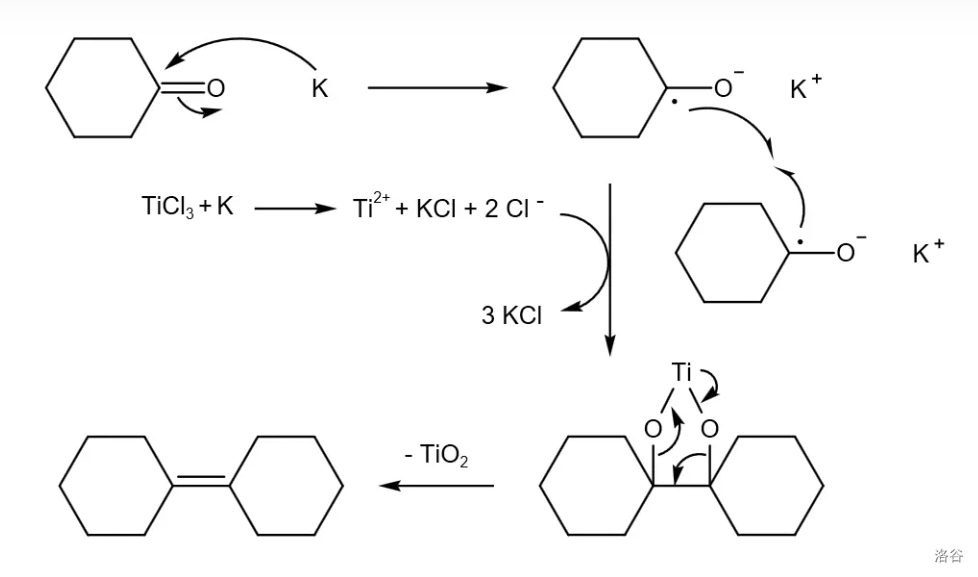
反应实例:
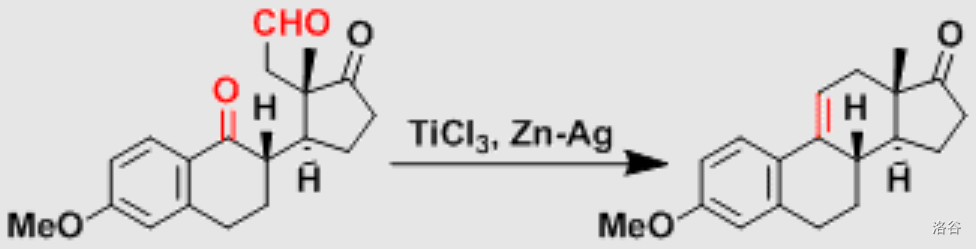
(上图:在一种甾族化合物的全合成中,使用 偶联反应构筑了第三个六元环)
25.Meerwin 芳基化偶联反应(1939)
芳香重氮盐对 不饱和羰基化合物的芳基化偶联反应,一般需要在 物种的催化下进行:

反应机理:
若 不饱和羰基化合物是 不饱和羧酸时,羧基常常会被脱去。反应实例:

(上图:肉桂酸和芳基重氮盐的 芳基化偶联反应可以用于制备芪类化合物)
26.Minisci 反应(1971)
在 与氧化剂(如 等)的作用下,羧酸(或硼酸酯)对缺电子(杂)芳香族化合物的自由基偶联反应:
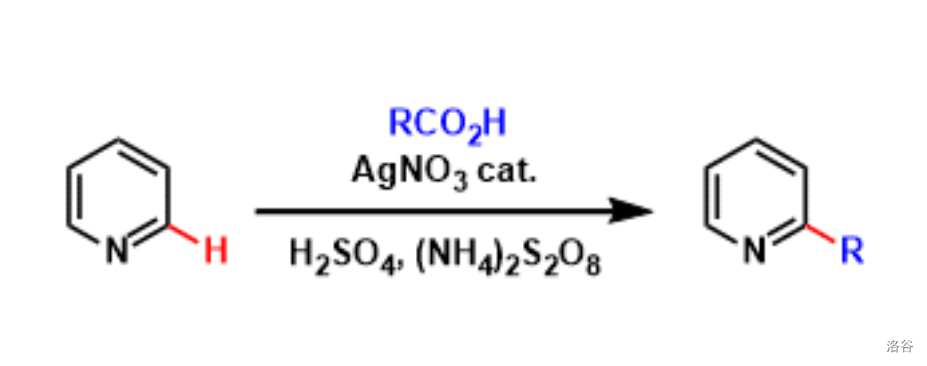
反应机理:

反应实例:

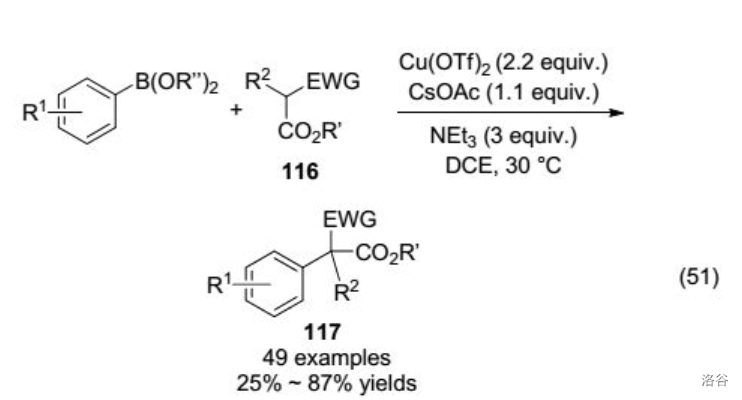
27.Miyaura 硼基化反应(1995)
也称为 硼基化反应,指 等金属催化的卤代烃与双硼试剂(比如著名的频哪醇二硼烷)的偶联反应。这个反应是重要的 键构建方法,得到的有机硼酸酯可以用于 偶联反应:

反应机理:
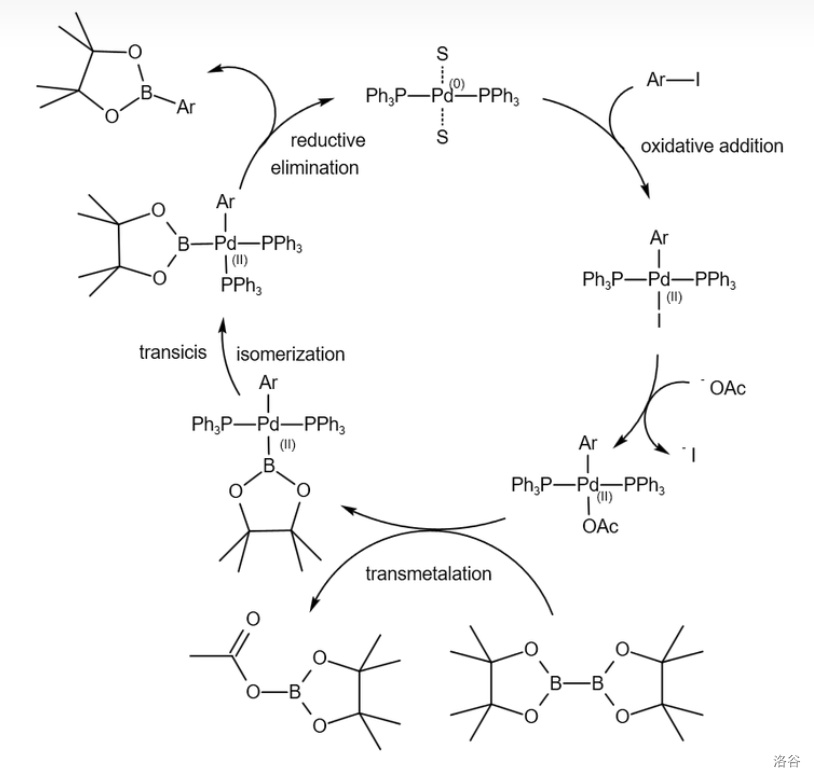
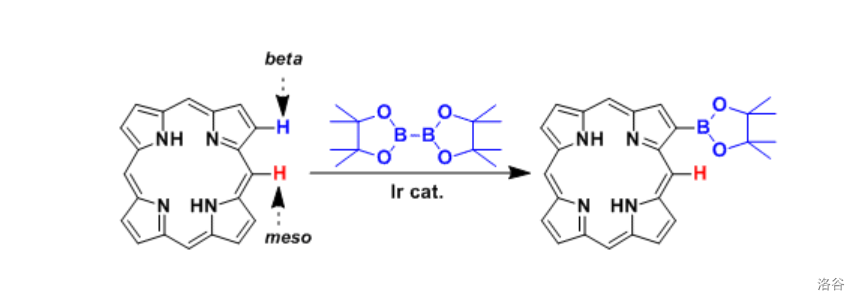
近年来,对该反应的一个重大改进是 键活化硼基化的实现。下面即是一例,使用 物种催化的对于惰性烷烃的末端官能化:

反应实例:
28.Mori-Ban 吲哚合成反应(1977)
通过分子内 反应合成吲哚的方法:
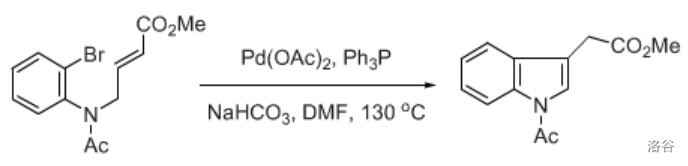
反应机理:
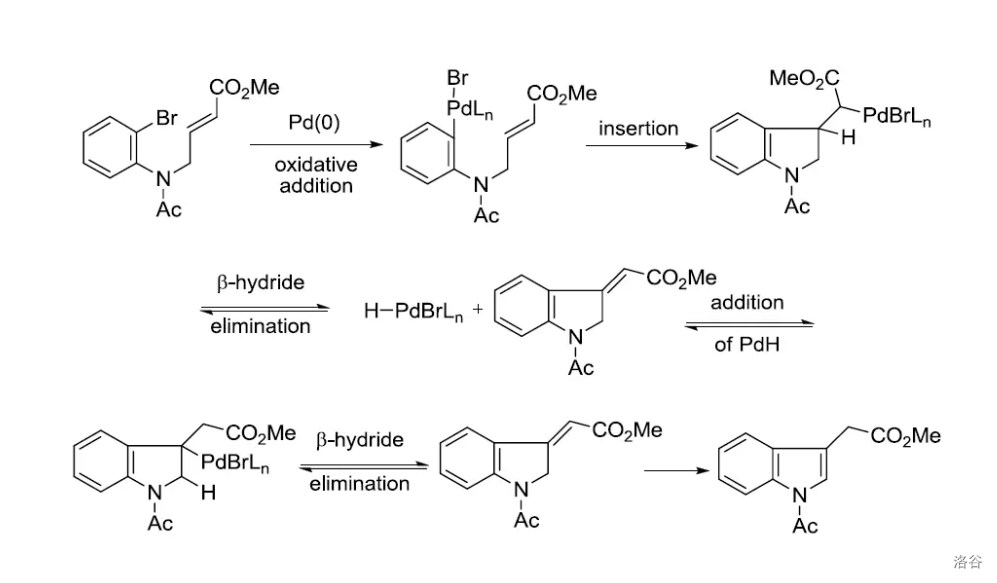
反应实例:

(上图:固相 吡啶合成反应的一例)
29.Morken 连续交叉偶联(2016)
在金属催化下,乙烯锂()、有机硼化合物和卤代烃之间的三组分连续交叉偶联。该反应可以采用简单的单官能团物质为起始原料,获得各类手性硼酸酯产物:
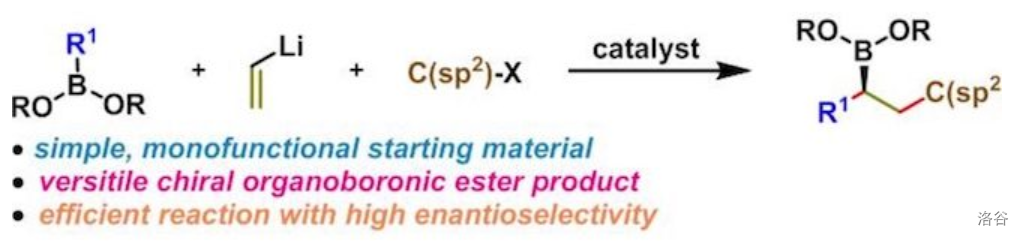
(注:指将两种电子供体底物与同一种电子受体底物之间进行的偶联反应)
反应机理(这里给出的是二茂铁基催化剂的机理,实际上还有很多催化剂可以催化这个反应):
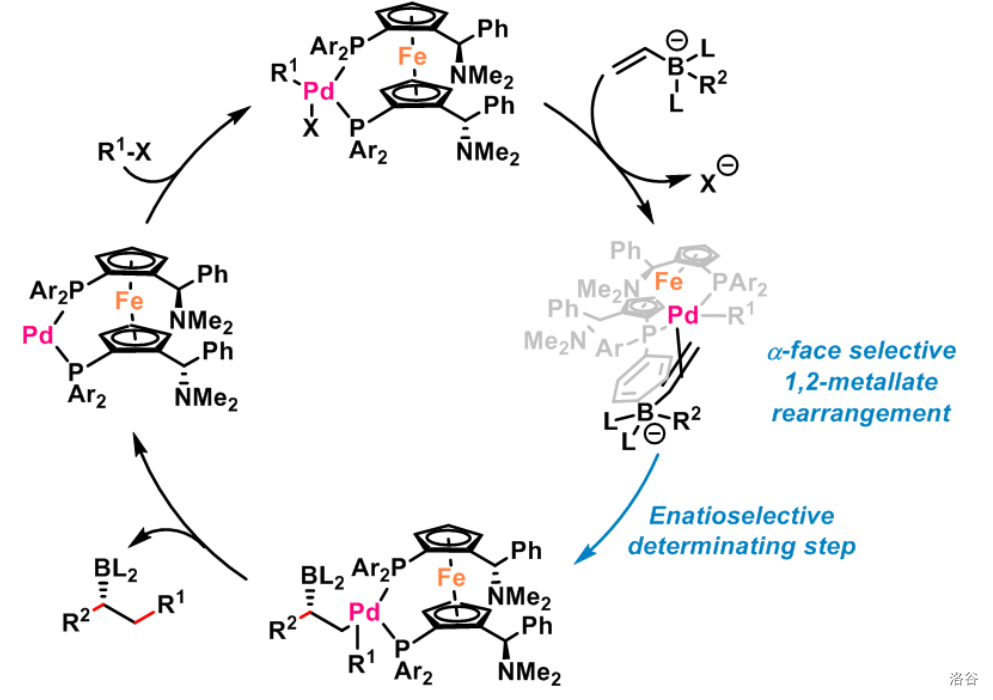
反应实例:
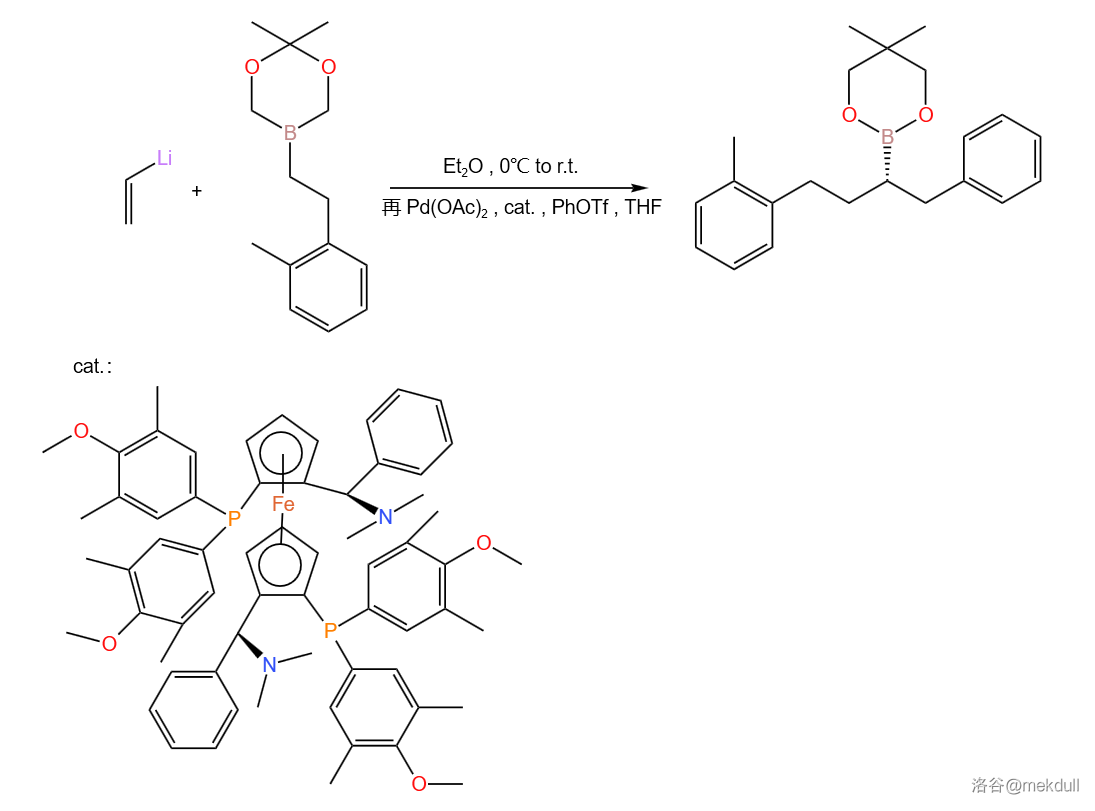
30.Nef 炔醇偶联(1890s)
炔化物(如炔钠()、炔(亚)铜()等)与醛(酮)偶联生成炔醇的反应。实际上,直接使用末端炔烃在强碱(如 )作用下也可以与羰基化合物加成:
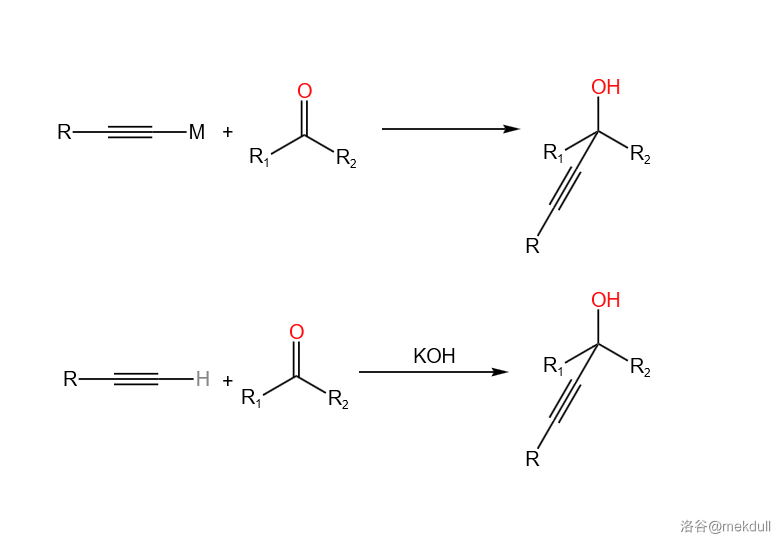
反应机理略。反应实例:
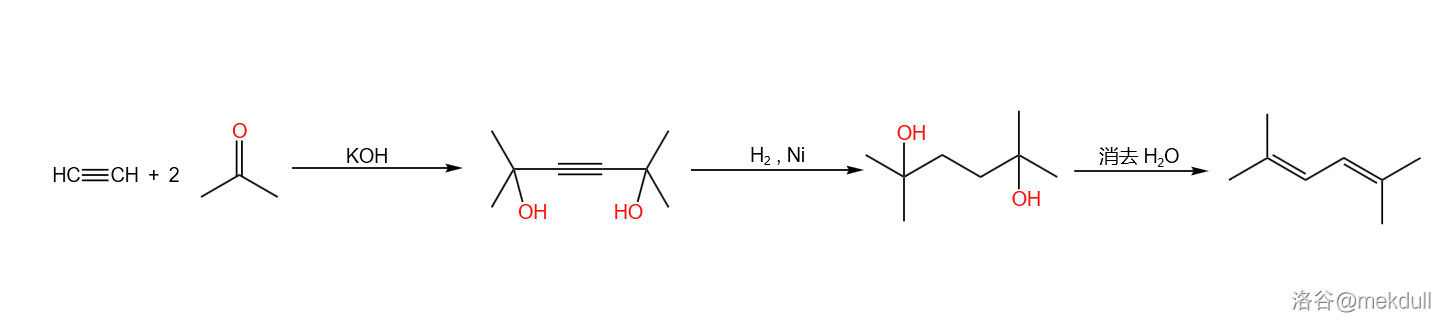
(上图:工业合成 二甲基已二烯(俗名八碳烯)的路线)
31.Negishi 交叉偶联反应(1976)
五大 催化的交叉偶联反应之一的 偶联反应是有机锌试剂与卤代烃(或磺酸酯)的偶联反应:
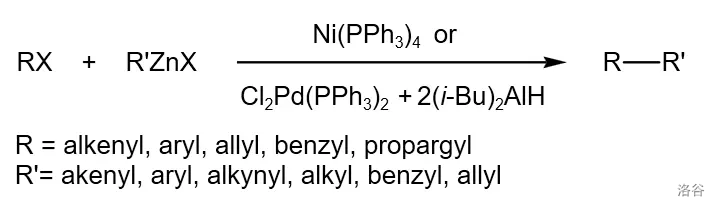
该反应是构筑碳碳键最为重要的方法之一, 教授也因此反应得到了诺贝尔化学奖。由于有机锌试剂不如格式试剂活泼,所以这个反应的副反应更少,产率也一般比 偶联反应高。同时,这个反应还具有比较高的化学兼容性,一般烷基锌试剂也可以正常反应。反应机理:

反应实例:

(上图:在 的全合成中, 偶联被用于烷基化)
32.Nenitshesku 酰基化(1931)
也称为 酰基化反应,是在 物种或 催化下酰氯对烯烃的酰基化偶联,类似于 酰基化:
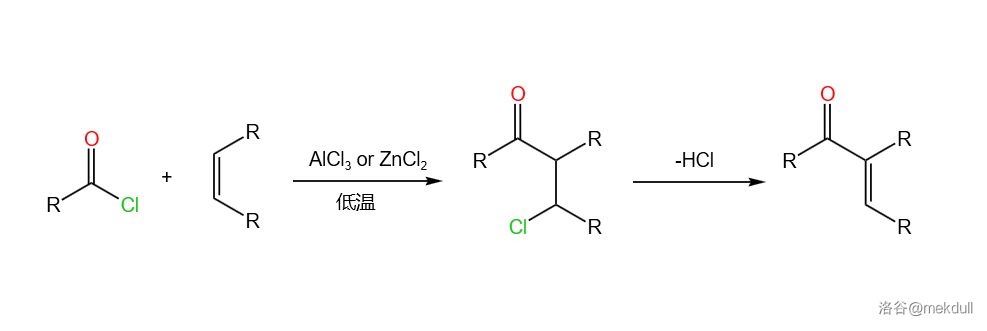
反应机理略。反应实例:
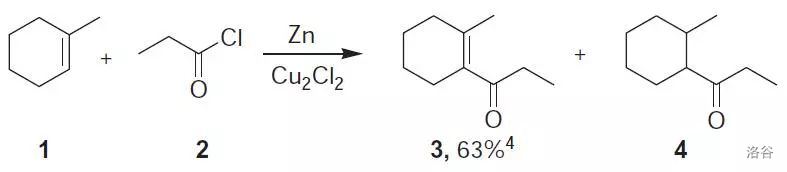
33.Nicholas 偶联反应(1976)
六羰基二钴配位的炔(由炔与八羰基二钴()反应得到)拥有稳定的炔丙基正离子,这个正离子可以与亲核试剂发生反应,得到偶联产物:
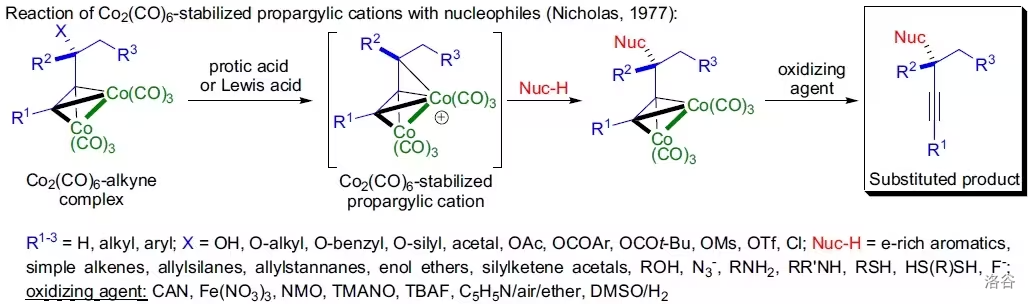
若要用这个反应实现 键偶联,则可以选用有机硅、硼化合物或有机金属试剂当作亲核试剂。
反应机理如下,产生的炔丙基碳正离子中间体被六羰基合钴络合后稳定:

反应实例:
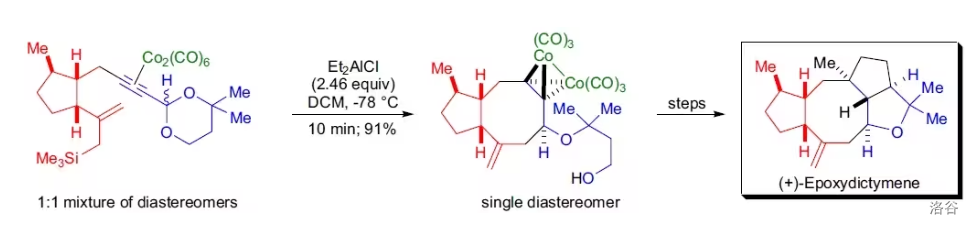
(上图:在 的全合成中,使用了有机硅化合物参与的分子内 偶联,并成功地以很高的产率构建起了分子内最具挑战性的八元环)
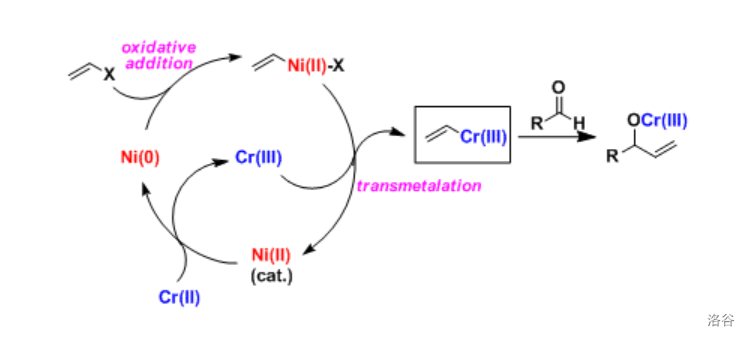
34.Nozaki-Hiyama-Kishi 反应(1977)
简称 反应。 双金属催化的烯基卤代烃与醛(酮由于空间位阻大一般可以保留)之间的偶联反应。反应实质上是有机 对羰基的亲核加成:
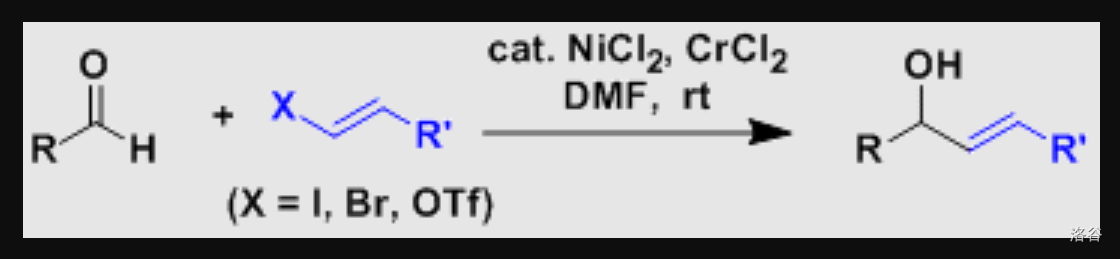
反应机理:
反应实例:
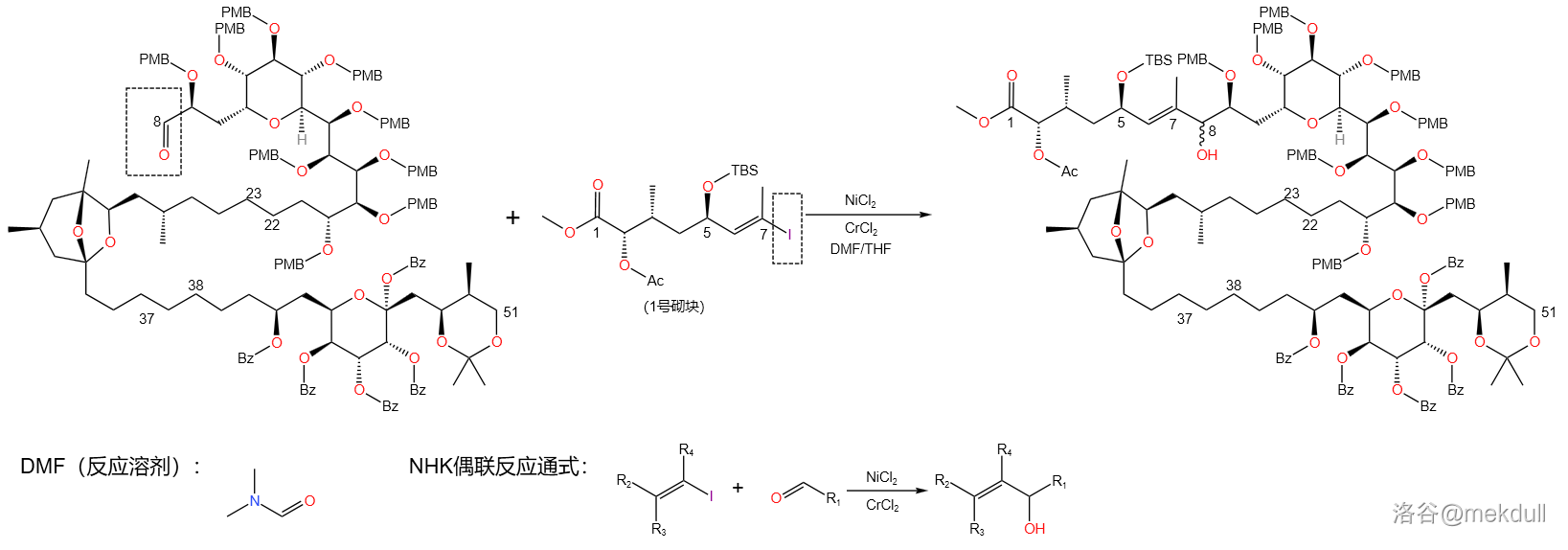
(上图:在岩沙海葵毒素的全合成( 课题组)中,多次使用了 反应来拼接各个砌块)
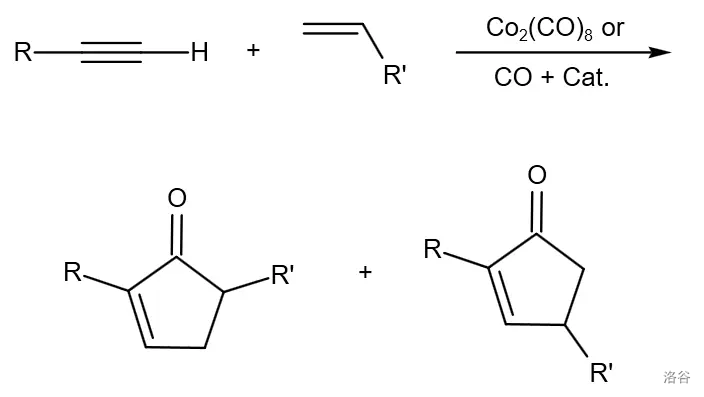
35.Pauson-Khand 反应(1971)
六羰基合二钴配位的炔(由炔与八羰基二钴()反应得到)与烯烃之间发生的 环加成偶联:
反应机理:

反应实例:
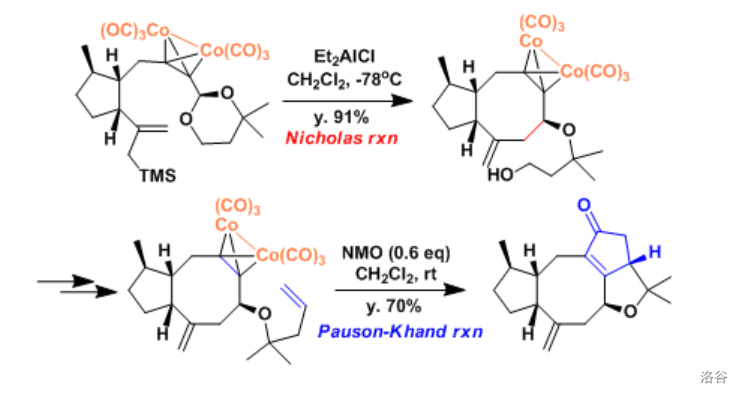
(上图:在刚才提到的 全合成的后续步骤中,重要的一步是利用 反应构建了两个稠合的五元环骨架)
36.频哪醇偶联(1859)
这是人类最早研究的,也是最经典的偶联反应之一,并且直到今天仍有广泛且重要的应用。两分子羰基化合物在金属(如 )作用下还原偶联为邻二醇:
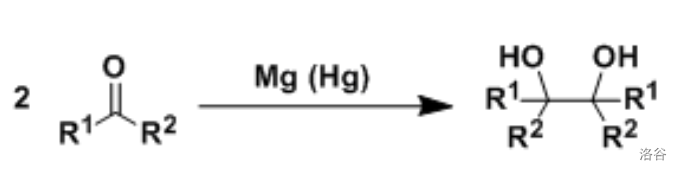
具有两个羰基的分子也可以发生分子内频哪醇偶联。这是构建环状化合物的重要方法,被广泛用于各种天然产物的合成。
反应机理:
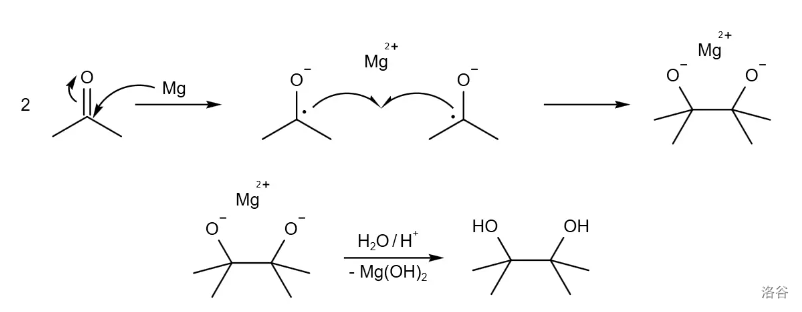
到今天,频哪醇偶联反应已经经过了一个半世纪的发展,出现了许多重要的改进。比如使用 偶联的反应条件、使用二碘化钐()介入实现高立体选择性的反应,或是使用手性催化剂诱导不对称反应。反应实例:
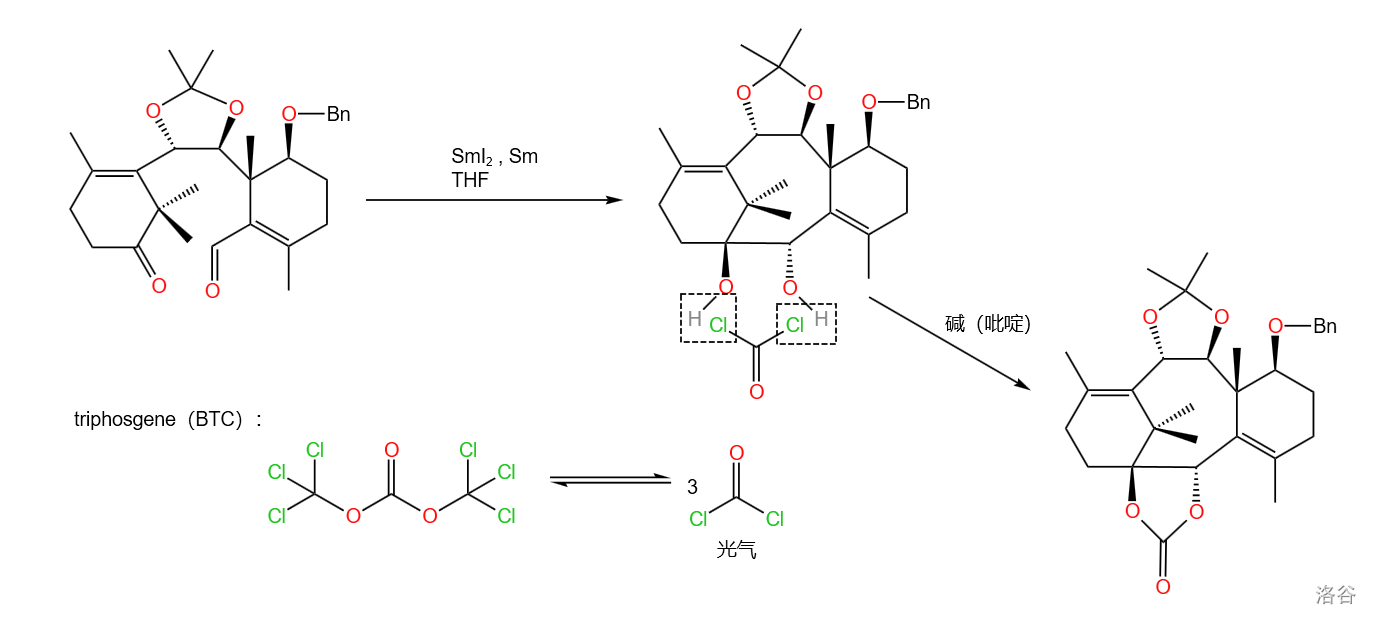
(上图:在李闯创课题组紫杉醇()的全合成中,使用了 介入的分子内频哪醇偶联反应,构建起了分子内最具挑战性的八元环,随后用三光气()保护邻二醇)
37.Pschorr 反应(1896)
分子内的 反应,通常会使用 物种催化:

这是最早的使用重氮盐的偶联反应之一,比重氮盐偶联和 反应都要早,而且直到今天仍然在稠环化合物的合成中有重要应用。
反应机理:

反应实例:

(上图:菲的一种合成路线,运用了 反应)
一个经典且重要的金属有机化合物参与的偶联反应,是指由 卤代酯得来的有机锌化物对羰基的偶联反应:
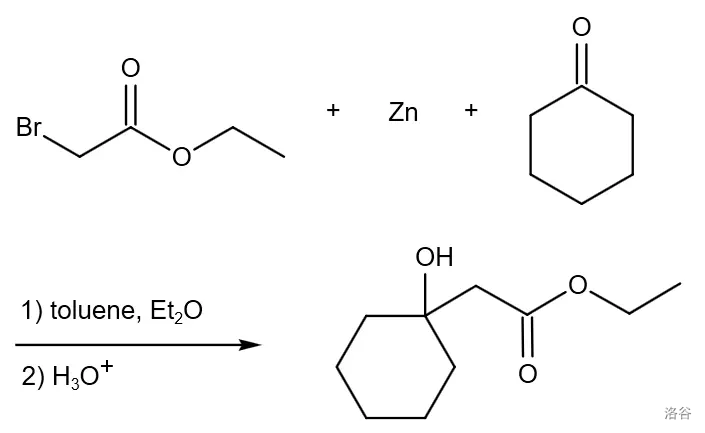
反应机理:

目前,该反应已经得到了很大发展,比如硼或 介入的 反应可以拓展到所有 卤代酮(醛),且具有良好的立体选择性。
反应实例:

(上图: 介入的 反应)
39.Sonogashira 偶联反应(1975)
又名 偶联反应,是指 物种催化的有机卤代物与末端炔烃的交叉偶联反应。相比于 偶联反应,其优点是只需要用到催化量的 :
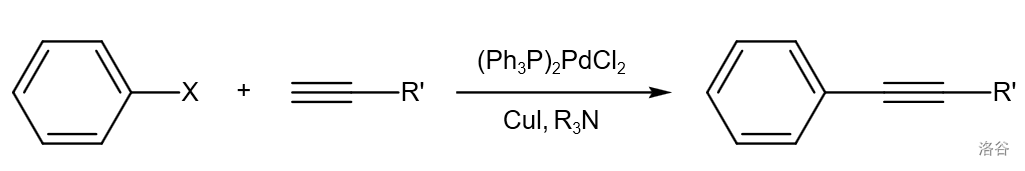
这个反应有一个明显的副反应就是 偶联反应,因此采用隔绝氧气、缓慢滴入反应物溶液或者加入还原剂(如 等)等方法可以增加产率。
反应机理:

反应实例:
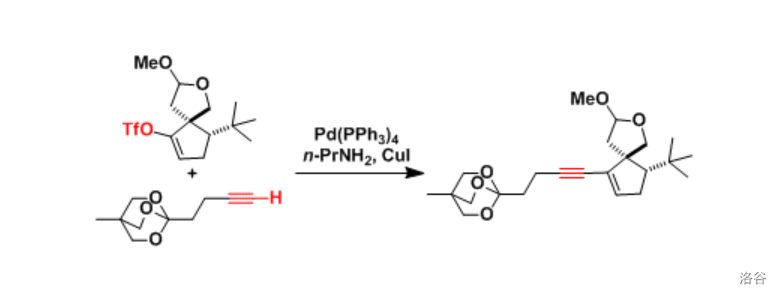
(上图:在 的合成中,采用了上述的 偶联反应)
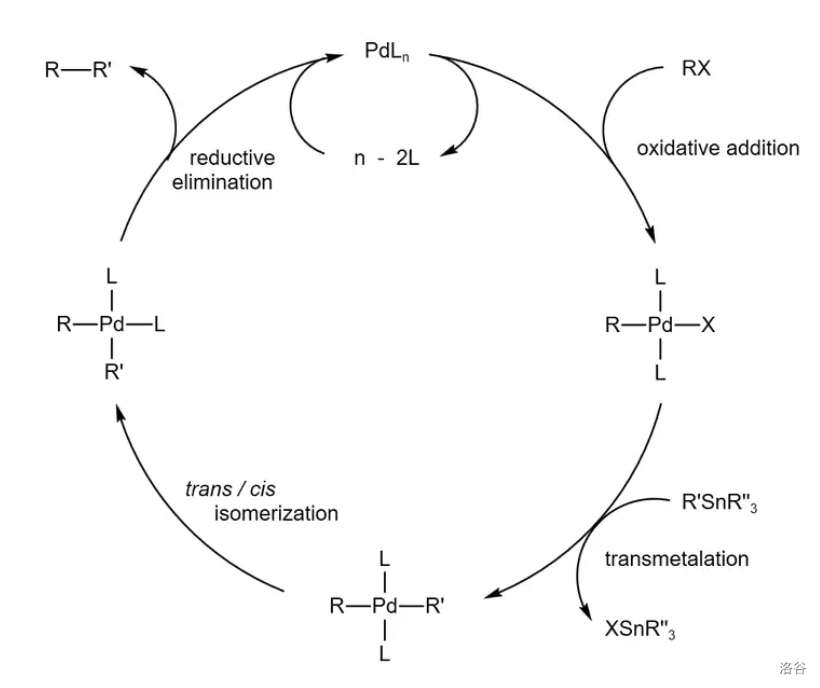
40.Stille 交叉偶联反应(1978)
五大 催化的交叉偶联反应之一,是有机锡试剂与卤代烃(或磺酸酯)之间的偶联反应:

反应机理:
反应实例:

(上图:在 的全合成中, 偶联反应被用来在分子上加上一个呋喃基)
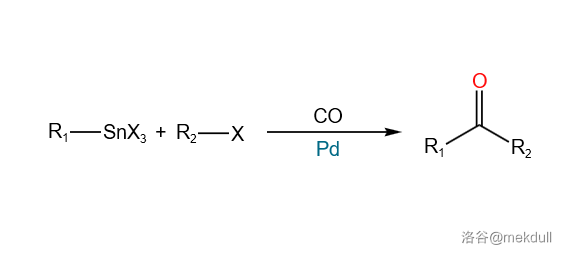
41.Stille 羰基化偶联反应(1984)
有机锡试剂、 以及一个卤代烃(或磺酸酯)在 催化下同时实现两个 键的偶联,给出酮产物的反应:
反应机理:
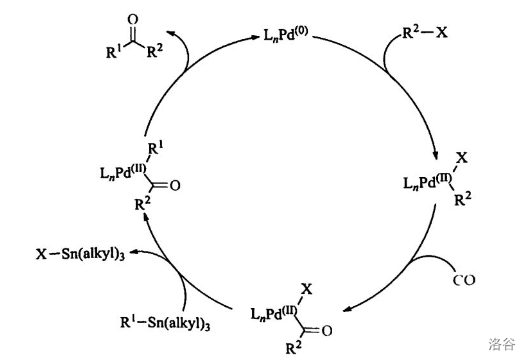
这是对 偶联反应的重要补充,这个方法也可以代替传统的极毒且容易造成环境问题的有机镉试剂用来合成酮(当然,近年来也出现了很多更好的插入 以合成酮的方法)。
反应实例:

42.Stille-Kelly 偶联反应(1990)
使用二锡试剂(如六甲基乙锡烷())进行的分子内 偶联反应:
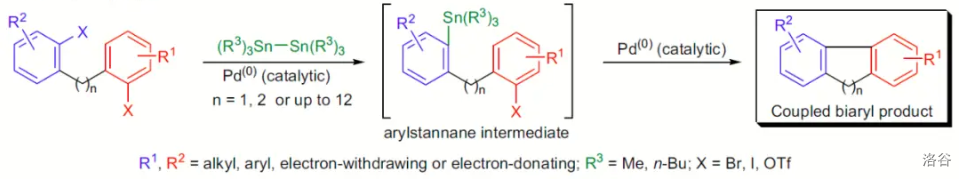
反应机理:
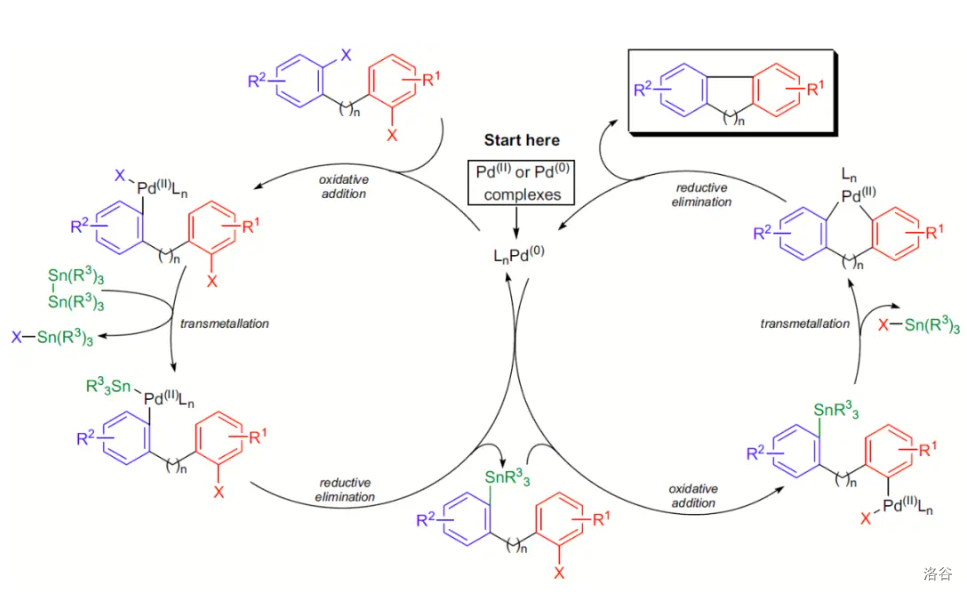
反应实例:

(上图:在 的全合成中,使用 偶联反应进行了分子内十六元环的关环)
43.Stork-Danheiser 换位偶联反应(1973)
烷氧基不饱和酮(醛)于格式试剂(或有机锂)作用,随后经酸处理得到换位偶联产物:

反应机理:
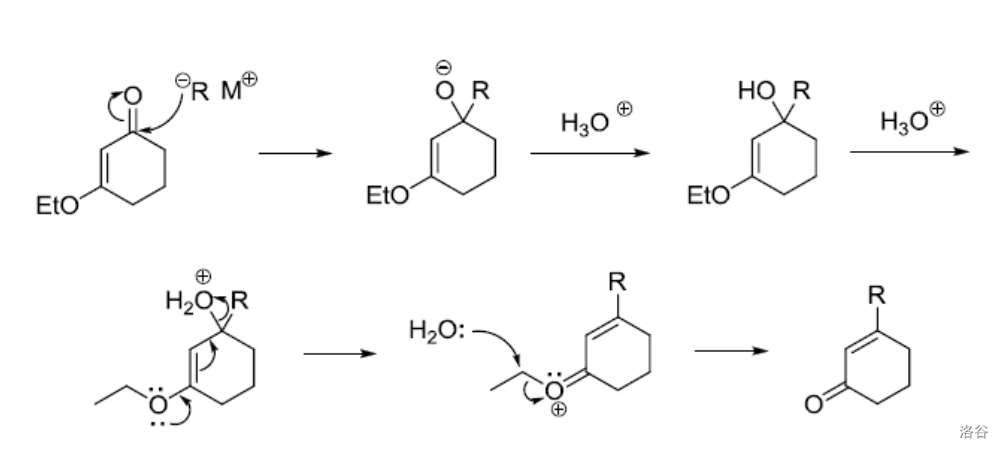
反应实例:
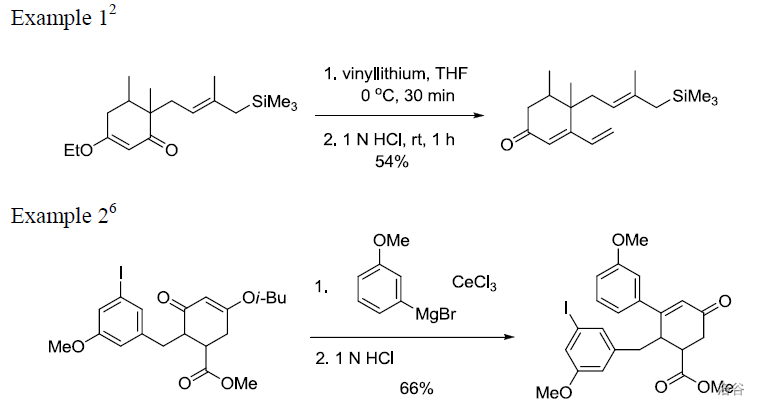
44.Suzuki 交叉偶联反应(1979)
又称 偶联反应,也是五大 催化的交叉偶联反应之一。它是有机硼化物与卤代烃在 与碱的催化下进行的偶联反应,也是当今用途最广的偶联反应之一:
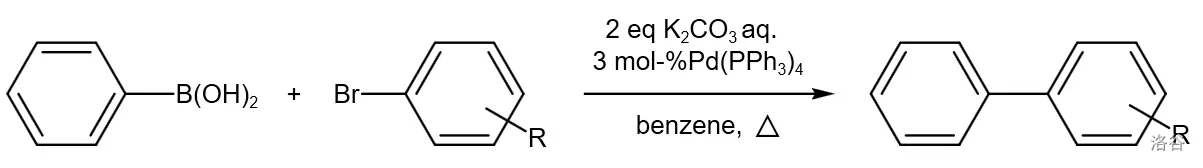
反应机理:

这个反应拥有具有较强的底物适应性及官能团容忍性,是很多有机合成路线中构建碳骨架的中流砥柱。近年来的一些改进更是把反应底物扩展到了烷基硼酸酯与烷基卤代烃,使得它都是应用范围得以进一步扩大。
反应实例:

(上图:在 课题组岩沙海葵毒素的全合成中,使用了 催化的 反应拼接两个砌块。上图中省略了 催化剂)
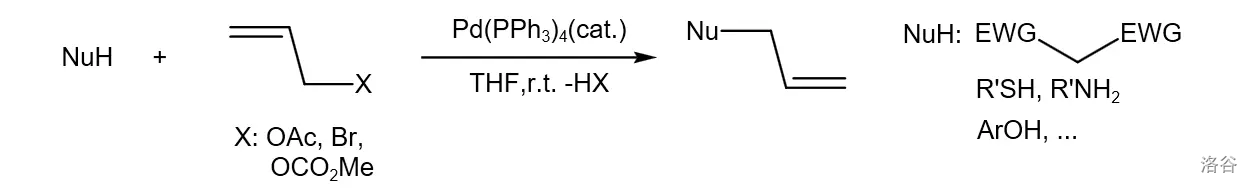
45.Tsuji-Trost 反应(1965)
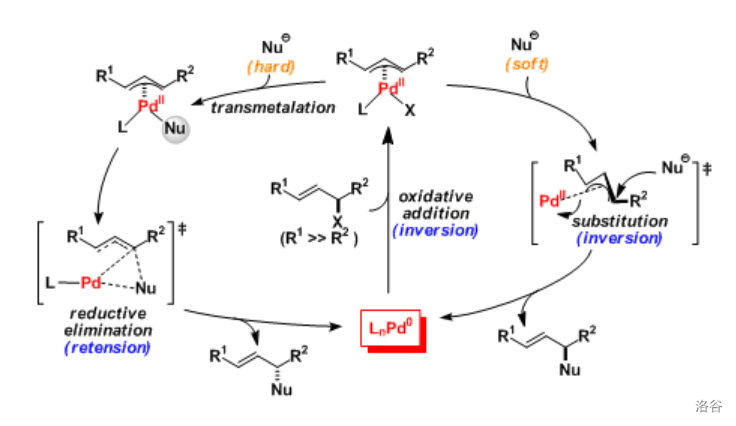
催化下亲核试剂(如活性亚甲基化合物,烯醇化合物,胺和酚)对烯丙基化合物(如烯丙基溴)亲核取代进行烯丙基化的反应:
反应机理:
反应实例:
(上图:在 的全合成中,使用了 反应构建了两个三级碳之间的 键)
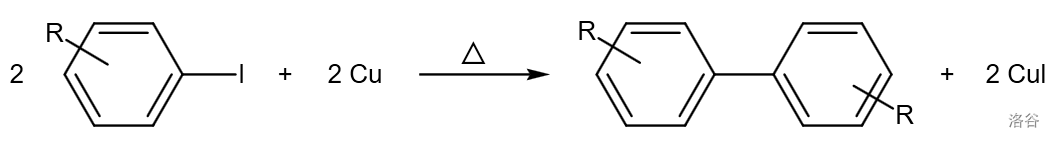
46.Ullmann 偶联反应(1901)
芳基卤化物在 (或 )催化下偶联为联芳基化合物:
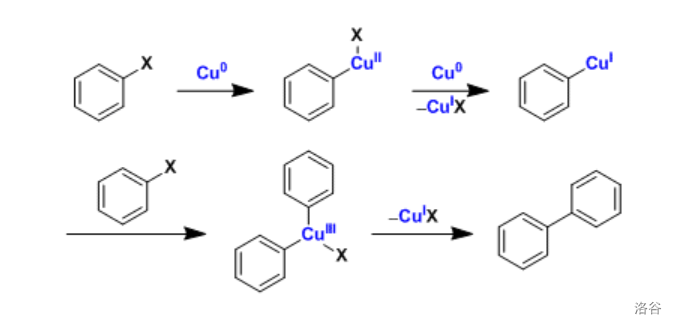
反应机理目前还不是很明确,主要由两种: 的机理和单电子转移()的机理。这里给出前者:
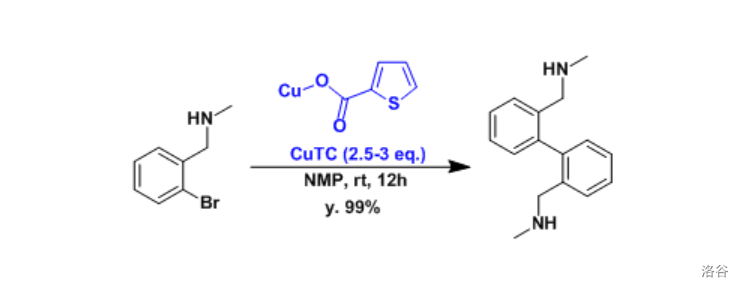
反应实例:
47.Wurtz 偶联(1855)
又名 反应。作为最古老的偶联反应之一,在人类有机化学史上,它和频哪醇偶联反应一起开启了金属催化偶联反应的黎明。在活泼金属如()的作用下,两分子卤代烃偶联为对称烷烃:
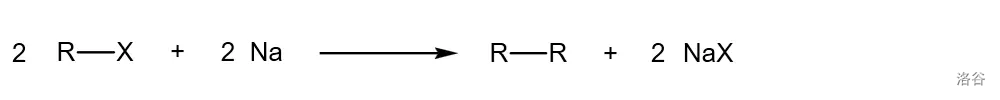
(注: 是频哪醇偶联反应的发现者, 和 是有机化学启蒙时期两位重要的化学家)
反应机理略。今天,由于产率低下,这个反应已经基本不再用于合成高级对称烷烃。但是,分子内的 偶联反应在“关小环”的时候相当有用,至今仍是合成三、四元环化合物的重要手段。反应实例:
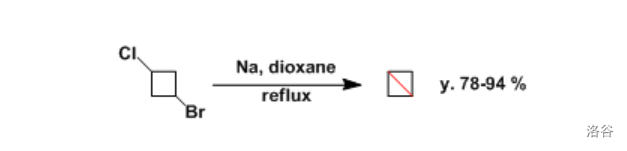
(上图:在双环丁烷的合成中, 偶联反应是决定性步骤,且产率很高)
48.White C-H键活化偶联(2004)
使用 催化剂()对烯丙基 键的活化后与亲核试剂的反应:

控制反应条件,可以主要得到直链产物()或支链产物()。
反应实例:
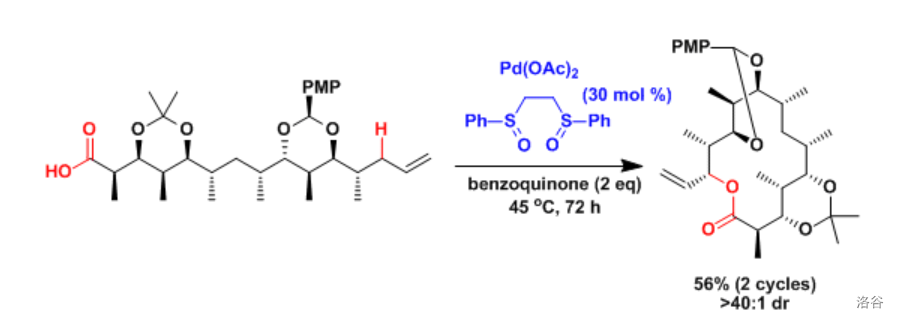
(上图:在某个天然大环内酯产物的合成中,使用了分子内的 偶联,得到了支链产物)
49.有机镉试剂的偶联反应(1900s)
使用有机镉试剂(如二烃基镉 ,烃基氯化镉 )作为亲核试剂对酰氯等进行的偶联反应。由于有机镉试剂很不活泼,所以大多数会与格式试剂反应的官能团(醛、酮、酯、氰基、硝基、一定条件下也包括卤原子)在此反应中得以保留:
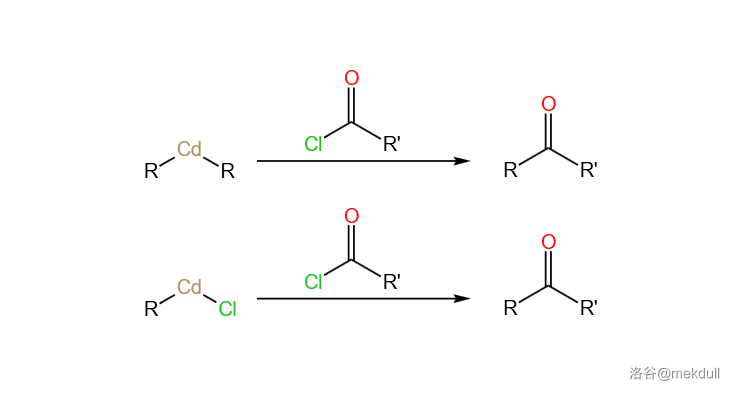
反应机理略。
有机镉试剂(还有它的兄弟有机汞试剂)原本是合成酮的重要试剂,反应适用性广且产率高,但在上世纪中后期一系列由 造成的重大环境事件后,这种方法就逐渐被取代了。尽管如此,许多有机化学基础教科书上仍然保留了一点这部分内容。是为了记忆,还是为了忘却?
有机镉试剂的制备:

50.Yu C-H键活化偶联(2010)
在一个特定基团的导向下, 与一个氧化剂共同作用将 键活化后进行偶联的反应:

反应机理略。需要注意的是,上图只是一个芳环上羧基作为导向基团的例子。 键活化偶联反应的含义非常之丰富,并不局限于羧基导向,也不仅限于芳环上。事实上,即使是困难的 键活化也可以用这个反应实现。如下例:
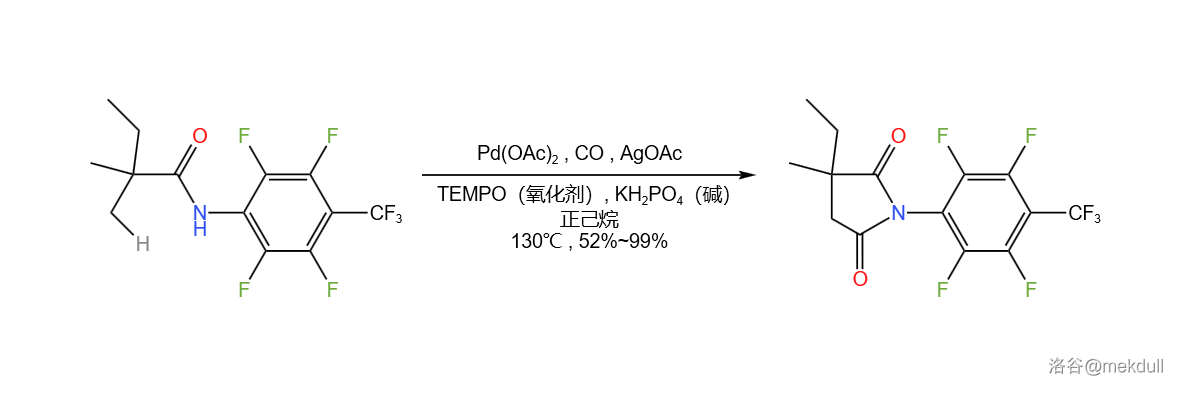
(上图: 作为氧化剂的酰胺基团导向的 碳原子上的 键活化,接着一个羰基化偶联)
反应实例:
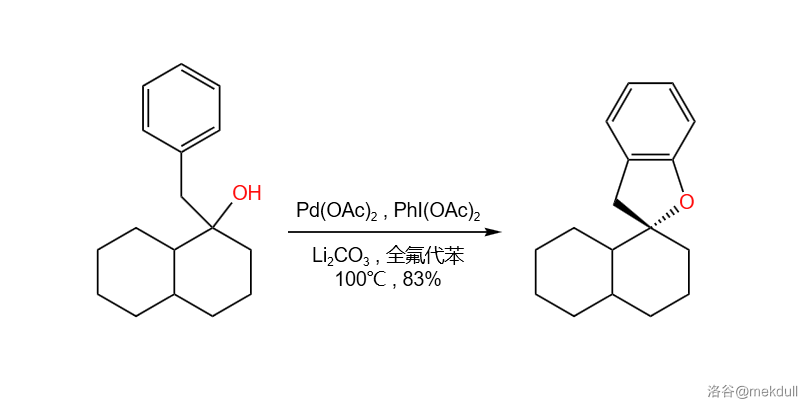
(上图:羟基导向的芳环上的 键活化,接着一个分子内的 键环化偶联反应)
结语
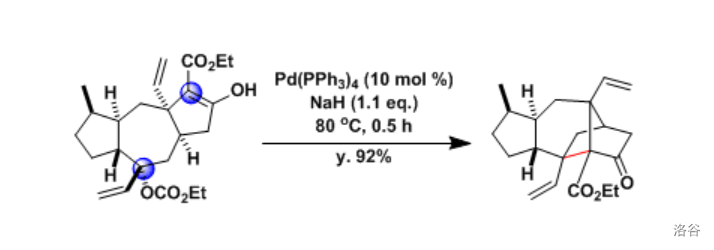
偶联反应作为有机化学中最重要的反应之一,到今天已经走过了将近 年的岁月。就像古老的宝藏一般,越是被时间打磨,越是焕发出炫目的光彩。历史上,那么多伟人为它呕心沥血,他们的名字灿若星辰,被永远镌刻在有机化学的名人堂中;而在今天,我们站在这些巨人的肩膀上,探索出了一大批更加普适、更加经济、更加巧妙的反应。下面就是一例新近发现的 物种催化的偶联反应,由南开大学朱守非教授团队报道,解决了 偶联的难题,并可以高产率地构筑季碳中心(论文链接):

(上图:铁催化的 偶联)

(上图:该反应中有效的一些铁基催化剂)
对偶联反应的探索不会停止。我们不会止步于眼前的辉煌,因为还有更大的挑战和机遇正在等待着我们。我们接过前辈的接力棒,并必将在这条大道上越走越远。
后附:几类重要的偶联反应发展线
芳基重氮化合物的偶联反应:
反应 重氮盐偶联 偶联反应 芳基化偶联反应 反应;
早期活泼金属(化合物)参与的偶联反应:
偶联、频哪醇偶联 反应、 炔醇偶联、 偶联反应 偶联反应 有机镉试剂的偶联反应;
催化的偶联反应:
偶联反应、 偶联反应 偶联反应、 吲哚合成 偶联反应、 吲哚合成 偶联反应 偶联反应 偶联反应、 吲哚合成 硼基化 反应 硼酸酯偶联
催化的偶联反应:
偶联反应 偶联反应 偶联反应、 偶联反应 偶联反应 偶联反应 偶联反应