引言
烷,这个字最初被赋予给了饱和碳氢化合物。任何了解有机化学的人都知道,它们的结构可以多么复杂多变,令人叹为观止。
但随着化学不断向前发展,人们逐渐发现,这项技术似乎也并不是碳的专利。先是各种高级硅烷和它们的衍生物,尽管 键比 键弱,硅原子自相结合成链的能力也比碳弱得多(至今在化合物中最长的确认的 链长度也只有 ,存在于 中),但这已经证明,作为碳的同族元素,硅元素氢化物的世界可能比我们早先想的更加复杂一些。

(上图:目前被确认的含有最长硅链的硅烷衍生物 )
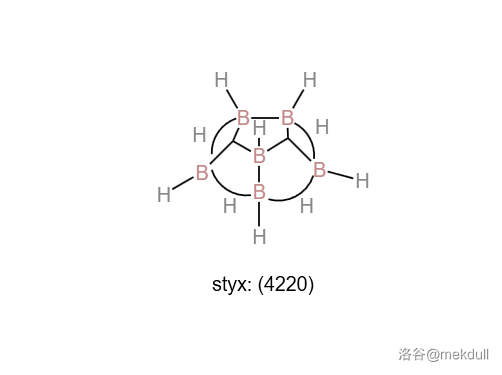
同样的事情发生在碳左侧的元素——我们今天的主角硼元素的身上。人们很早就合成了最简式为 的硼烷,但早期化学家就注意到了这种物质似乎并不简单。一切实验都证明,这种物质的化学式应为 ,即乙硼烷。到了 世纪初,一位名为斯托克()的化学家的团队分离并鉴定了一系列硼烷,如 等,从而开创了硼氢化学这一至今依旧活跃的领域。但在很长一段时间中,化学家对于这些物质的结构束手无策。
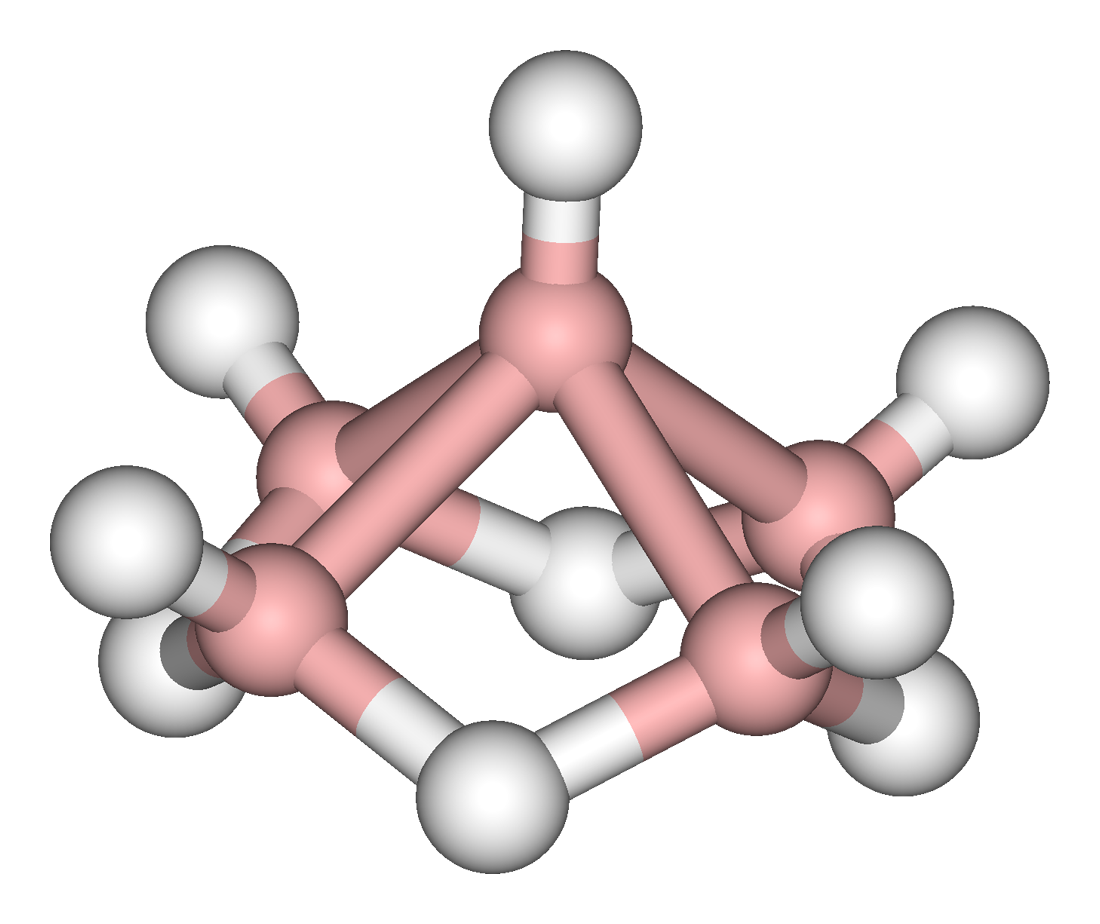
(上图:戊硼烷的结构,红色球为 原子,白色球为 原子)
当时,化学家还普遍认可硼三价理论,但现在的我们知道,这一理论几乎无法应用于硼烷及其衍生物。直到量子论的发展触及到了化学领域,量子化学兴起了。于是,在价键理论之外,我们又有了更多对付分子的工具(比如分子轨道理论())。 世纪中期以后,人们提出了各种各样的针对硼烷结构的理论,它们才终于被揭下了面纱。
可研究越是深入,硼烷,就越显得奇怪、诡异。它们身上还有太多秘密,至今仍未解开。
所以,现在,就让我们去深入了解一下这类奇妙的物质。我不想把文章写得太浅,想写一些有深度但也更有意义的东西(不用担心,这毕竟是一篇闲谈,所以也不会太复杂)。但请相信我,当你理解了这些后,一定会叹服于自然的美妙。
正文
预备知识一:三中心键理论
就像上文中所说的,朴素的价键理论在硼烷这里遇到了严重的困难。 年,利普斯科姆()提出了三中心键理论来解释硼烷中的成键,获得了很大的成功。这一切使得他获得了 年的诺贝尔化学奖。
(注:彻底理解这个理论需要前置知识分子轨道理论,如果不懂可以看看这篇或者这篇。)
为了便于表述,我们用 表示一根化学键涉及 个中心原子(,中心), 表示这根键中含有 个电子(,电子)。那么, 就可以用来形容这根键。
举个例子,普通的硼硼键()就可以写成 硼硼键。
但是,理论认为,除了经典的 键和 键等 键外,还应有更多成键要素,比如下面这些:

以 氢桥键为例,在这种键中,两个 原子提供两个 杂化轨道(其中一个轨道上没有电子), 原子提供一个 轨道,组成 个分子轨道,并将两个电子填入成键轨道。硼桥键与之类似。
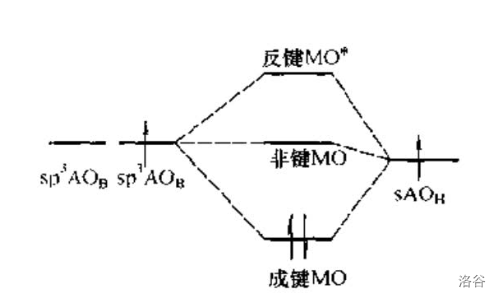
但注意到,硼桥键有开放式和闭合式两种,这是因为它们的轨道重叠方式不同。如下图,闭合式硼桥键的 个轨道的正相位重叠, 个 原子完全等同;开放式硼桥键则是中间轨道的正、负相位分别与两个轨道的正、负相位重叠,两侧两个轨道之间没有重叠,因此中心 原子与两侧 原子不等同:

这种三中心两电子键是为了解决 原子的缺电子问题。这点从经典的八隅律也可以解释: 原子最外层只有 个电子,即使全部成键也只有 个电子,达不到 电子的稳定结构,因此需要成特殊的 键,因为这样两个电子就可以被 个原子共用,最终可以实现所有原子都达到 。
需要注意,这种键在缺电子元素(如 等)形成的许多共价化合物中都可以见到,不仅限于硼烷。比如说下面这个 ,还有两种构型:

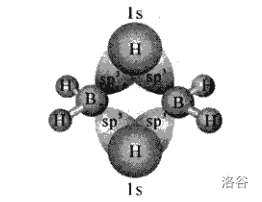
有了这个,我们就可以解释 的结构了。 原子采用 杂化,两个位于平面内的 原子团以平面上下两个对称的氢桥键连接:
最后还想说一句重要的:
定域的三中心二电子键理论配合杂化轨道理论虽然可以很好地解释绝大部分较简单硼烷的成键,但对于一些更复杂的硼烷以及硼烷离子等的成键,这种理论就显示出短板了。事实上,很多复杂硼烷(及其衍生物)的成键直到现在仍然是个谜。
预备知识二:硼烷的特征数与styx
注:下面两小节会涉及硼烷的理论计算,虽然我认为理解起来并不是很难,但如果实在没有兴趣的话直接跳过对剩下的内容也没有太大影响。
在上面理论的基础上,我们来进一步探索硼烷的结构。对于通式为 的硼烷,令:
-
表示分子中氢桥键的数目;
-
表示分子中硼桥键的数目;
-
表示分子中 的硼硼键的数目;
-
表示切向的氢原子数目。
(注:我们认为每一个 原子都至少以 键结合了 个 原子,这个 原子被称为端基氢原子;除了这些氢原子外,其他以 键与 原子结合的氢原子称为切向氢原子。)
可以列出方程组:
式的含义式氢原子守恒; 式的含义是 原子的价电子守恒; 式的含义是 原子的价轨道守恒。联立化简上方程组,得:
可以看到,这是一个不定方程组,理论上有无数组解。但注意到,所有未知数都是自然数,所以解的组数其实是有限的。
举个例子:解出 (丁硼烷)的 。可得到 ,,则:
显然 只有 两个值可以取,那么解出两组 : 与 。以此指导结构的书写如下:
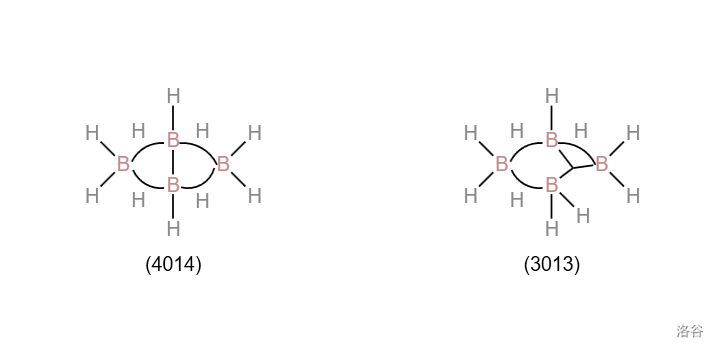
显然前者 的对称性更好,猜测其更稳定, 应以前者结构为主。对 的结构进行实验检测,发现与理论完全符合。
预备知识三:维德规则(Wade’s Law)
年,美国化学家维德()在分子轨道理论的基础上提出了一个预言硼烷及其衍生物结构的规则,通常称为维德规则。其基本含义是硼烷的结构是由其骨架成键电子对数(一般记为 )决定的。
现今得到的硼烷结构一般有三种基本类型:闭式(),巢式()和网式()。示意如下:

(注:其实还有比较罕见的链式(),上图里没有表现出来)
对于硼烷及硼烷阴离子,其通式可以写为 ,那么骨架成键电子数 。很好理解,无论怎么成键,每个 原子团都提供两个电子,其余每个 都提供一个电子,再加上它的负电荷就是骨架成键电子了。所以 。
设骨架有 个顶点。对于硼烷及硼烷阴离子,显然有 。维德规则规定:
若 ,那它是闭式结构;
若 ,那它是巢式结构;
若 ,那它是网式结构。
(注:刚才提到的罕见的链式结构对应 。)
将其拓展至通式为 的碳硼烷(一类由 取代部分 原子构成骨架的硼烷衍生物),维德规则同样适用,只是此时 , 罢了。其他什么磷硼烷、硅硼烷、硫硼烷等都可以这样处理。
这个规则究竟是怎么推导出来的,在此并不详述,但是还是可以给一张图,这张图表示了假想的由闭式()转化为巢式()、蛛网式()的过程:
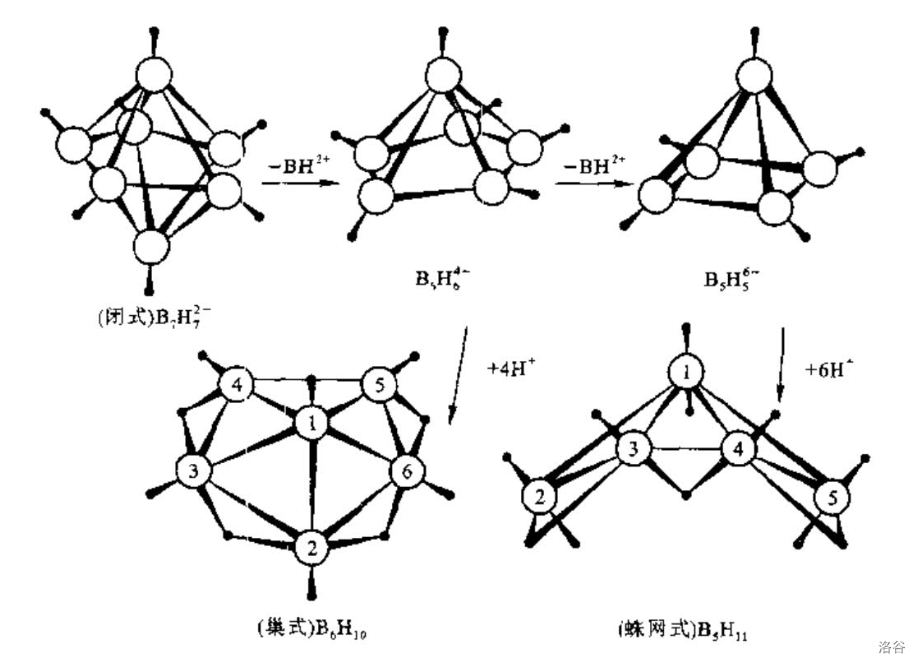
最后应该注意, 规则只能预测结构类型,不能预言具体结构,而且也有一些硼烷(衍生物)不符合 规则的语言。尽管如此, 规则简洁、深刻,是目前预言硼烷、硼烷衍生物及簇状化合物最好的规则之一。
中性硼烷的结构与性质
已知的中性硼烷大致可以分为两个家族:通式为 $\ce{B_nH_n_+4}\ce{B_nH_n+_6}Wade$ 规则的预言。
硼烷的命名法继承自烷烃。举几个例子就很容易掌握,巢式结构的 被命名为戊硼烷(11),而具有相同硼原子数的网式结构的 则命名为戊硼烷(11)。
下面是两大家族的一些较重要的成员。由于绝大多数硼烷极不稳定,所以能够出现在下面的都是家族中比较稳定的怪胎。
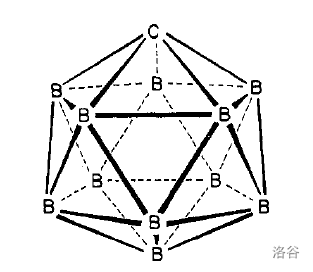
巢式结构家族中首先出场的是乙硼烷(6)。作为最早被发现的硼烷,它的结构在上面已经展示过,这里再放一次:

乙硼烷在室温下稳定,但遇到氧气会自燃。它在水中立即水解,放出 :
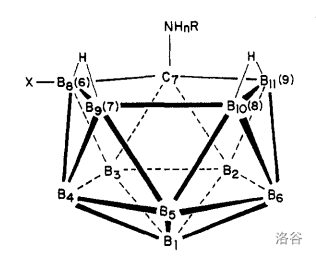
下面的丙硼烷、丁硼烷都很不稳定,但 戊硼烷(9)、己硼烷(10) 都在室温下稳定。两者的结构在上面都出现过了,这里再把后者的结构放一下:
两者在室温下都是液体。戊硼烷在室温氧气中自燃,但在隔绝氧气时加热到 才开始分解;己硼烷则在室温下不会自燃,但只要高于室温就会缓慢分解, 以下即分解完全。它们的水解都极其缓慢。
接下去的几个硼烷都是极不稳定的,辛硼烷在 就分解得一塌糊涂,壬硼烷和庚硼烷不稳定到根本找不到资料。仅从这里看,会发现硼烷大致上与硅烷类似,硼原子越多越不稳定。但是下一个,癸硼烷(14) 却是画风突转。它极其稳定且容易值得,这也使得它经常成为硼烷的代表。很多人口中所谓的“固态硼烷”一般就是指这玩意。

(上图:癸硼烷实物)
它在室温下是白色固体,在 融化(不隔绝空气会燃烧), 沸腾为气体。其结构如下:
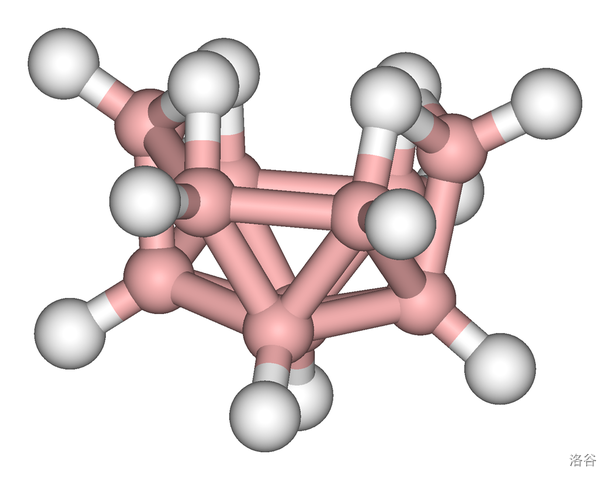
即使加热到 ,癸硼烷都没有什么分解迹象;与水可以反应,但常温下极慢;在空气中一点就着,但不会自燃。由于这些性质,癸硼烷可以被用作固态燃料、除氧剂等。
癸硼烷的稳定性也可以从热力学数据看出来。一般来说,随着硼原子数变大,硼烷的生成焓 数值应越来越大。但癸硼烷彻底打破了这一规则,见下表:
| 硼烷 |
化学式 |
生成焓 |
| 乙硼烷(6) |
|
|
| 戊硼烷(9) |
|
|
| 己硼烷(10) |
|
|
| 癸硼烷(14) |
|
|
这种稳定性出自于何处?即使到现在,我们也不是很说得清楚。这就是硼烷诡异的地方——稳定的硼烷夹杂在一大堆不稳定的硼烷之间,往往就是一个稳定的硼烷,只要多一个或者少一个硼原子就会变得极不稳定。近些年的研究表明,这或许与一种奇特的芳香性有关。
相比之下,另一个家族——蛛网式结构家族就寒碜得多了。之前见到过的 丁硼烷(10) 虽然已经被测定结构,但这个分子本身极不稳定,常温下迅速分解甚至爆炸。接下来的戊硼烷、己硼烷、庚硼烷、辛硼烷都极不稳定,最多在室温下稳定几个小时。唯一拿得出手的算是壬硼烷(15),结构如下:

它在室温下稳定,不会自燃,水解也比较缓慢。比较特别的是它的熔点只有 ,在室温下是液体——这个熔点比戊硼烷整整低了约 !这显然是一种反常。但到底为什么——目前也没人说得清楚。
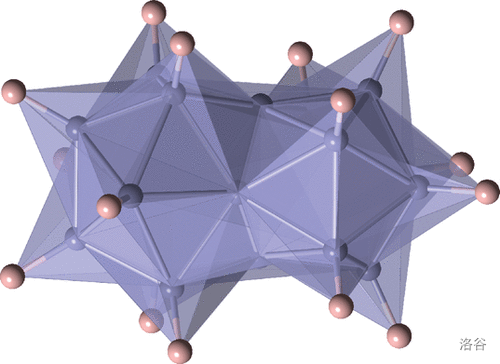
除了这御两家之外,人们还合成了一些闭式的硼烷。然而就是这其中的一个将硼烷的诡异程度提升了一个境界。 年,人们合成了二十硼烷(16)。没错,,硼原子数比氢原子数还多!经测定,它的结构如下,由两个正二十面体共用两个面稠合而成:

这种物质中含有四种环境的硼原子,比例为 ,如下图:
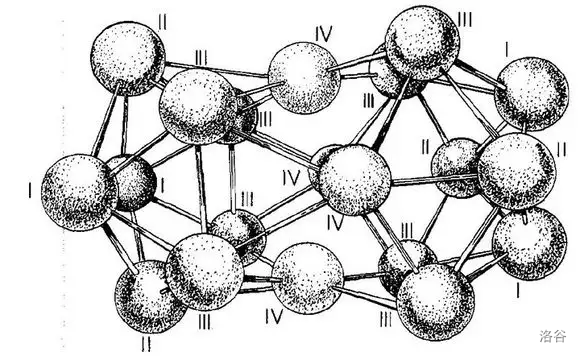
诡异的事情是,中央的四个 号 原子根据键长测定,与周围整整 个硼原子键合。更加诡异的是,经过分子拓扑学的研究,这个分子的张力极大,大到在传统理论中根本不可能稳定存在,但事实是,这种物质极其稳定,甚至超过了 !
直到现在,我们都无法完美地解释这种物质的结构与性质。我们手上拥有的,几乎一切的理论工具(包括上面说过的针对硼烷的三中心键理论)全部失效了,往常的经验也被它摧枯拉朽般粉碎——这使得它成为了一代结构化学家的梦魇。
近年来,一些研究证明这个分子具有极强的芳香性,这似乎为解决这个难题带来了一丝曙光。做个对比,萘的 (一个判定芳香性大小的数据,绝对值越大则芳香性越大)为 ,而 的 为 ,说明它的芳香性强于萘。而对它键能的测定更是让人惊讶——分子中 键(假定分子中确实有这个键)的键能超过了 ,甚至高于 键!
根据较新的测定结果, 的分解温度超过 (完全分解所需温度更高),别说其他硼烷,就算是碳基烷烃的热稳定性也不比它好多少。下面是这东西的另一张更好看的结构图:
以上就是各种稳定、常见的中性硼烷的结构与性质了。在继续前进之前,我们还要去看看这些千奇百怪的硼烷到底是怎么被制备出来的。相信我,那会同样精彩。
中性硼烷的制备
最简单的乙硼烷可以通过硼化物的水解得到。 与 在高温下反应得到硼化镁(),而 可以与酸作用得到乙硼烷:
实际上,这个方法产率很低。因此,更好的是使用硼氢化钠()与酸反应,使用 可以得到较纯产物:
比较新的方法是使用 还原 或者是 。这样制得的乙硼烷很纯,可以观察到在空气中自燃产生的绿色火焰:

硼烷的一个重要的性质是自组织性。在一定条件下,小分子硼烷会自动组织为更稳定的大分子硼烷。毕竟某些大分子硼烷是更加稳定的,而物质总是会向着更加稳定的方向前进。各种高级硼烷的制备一般都是应用了这个性质。
在适当加压时, 分解主要得到 。若反应不在低温下进行,则 继续分解得到一大堆高级硼烷的混合物:
在氢气存在下, 在 下可逆地热解得到 :
在二甲醚中, 在 时热解得到 :
还是要提醒一下,几乎所有硼烷都是剧毒(甚至极毒)且高能的物质,因此千万不要在没有严密保护措施的情况下进行这些反应。人们曾经也尝试过使用硼烷作为火箭燃料,但终究是因为其毒性和难以保存而放弃了。
在 (四氢呋喃)中, 与氨气反应,生成硼烷氨络合物()反应实质上是 (硼烷的四氢呋喃络合物)与 发生的配体交换:
在外观上,它是白色固体粉末,与一些高级硼烷难以区分。其结构如下, 与 之间的化学键可以认为是配位键:

它是一种储氢材料,在真空中加热很快便会放出 而留下氮化硼()。在空气中燃烧时会放出硼烷同款的绿色火焰。
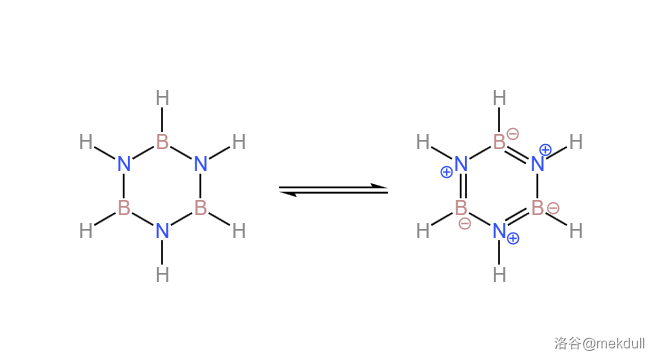
如果是在气相,那么高温下 和 就会生成环氮硼烷(),俗称“无机苯”。如下图,其结构与苯十分类似:
硼烷阴离子的合成与反应
硼烷在碱的作用下,可以发生裂解。裂解可以分成两种:对称裂解和不对称裂解,其中后者会产生硼烷阳离子和硼烷阴离子:

一般来说,硼烷与较大的路易斯碱反应发生的是对称裂解,而与较小的路易斯碱反应则发生的是不对称裂解:
(对称裂解)
(不对称裂解)
(不对称裂解)
于是,我们就可以利用裂解制出各种硼烷阴阳离子(但这篇主要讨论阴离子)。比如,最简单的硼烷阴离子 的制备如下:
(注:更安全、方便的制法是把乙硼烷换成硼酸三甲酯())
裂解法是合成硼烷阴离子的基本方法之一,但当需要合成高级硼烷阴离子时,这个方法就不那么有效了。此时一般使用的是去质子法。比如, 在水中的 ,早在 年,人们就发现它可以被 夺去一个质子,得到 (癸硼烷(13)阴离子)。其结构如下:

在乙醚中,这种离子呈现出艳丽的黄色。它可以与路易斯碱在 号位结合,结合之后黄色会逐渐褪去。
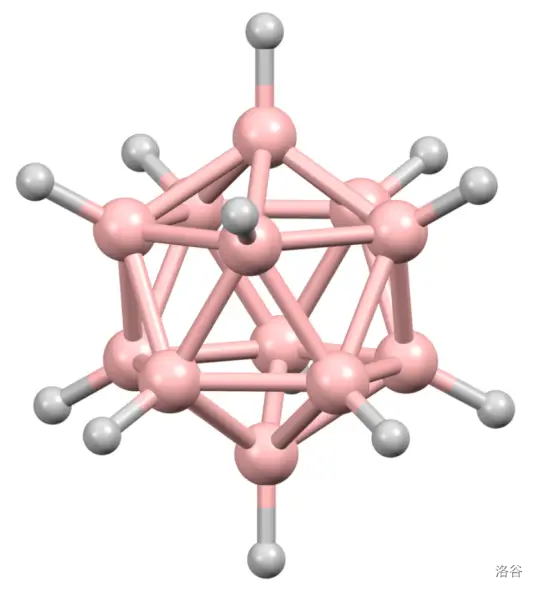
在这类阴离子中,最引起人们兴趣的是一类通式为 的闭式硼烷阴离子。目前, 的闭式硼烷阴离子都已被合成。人们发现,这类阴离子的骨架键和电子存在高度的离域性。这之中最稳定的当属闭式十二硼烷阴离子(),其制备如下:
其结构如下,是一个非常漂亮的由 个三角形面构成的正十二面体。正是这种对称性极强的结构赋予了它极高的稳定性,在 以下不会分解,即使超过了它的分解温度,实际反应也非常缓慢。
不与酸碱作用,即使是很浓的酸( 以下)或是很浓的碱都不会使其发生水解,足见其稳定性。
除了 以外,另一个稳定的是 。它的结构是一个十六面体(不可能是正的),对称性稍微差一点。下面是它的俯视图:
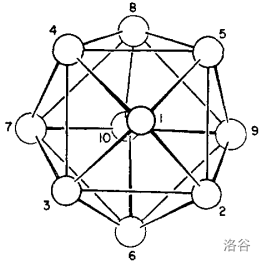
(制备方程式:)
另外的那几个对称性更为低下,自然也就更不稳定。比如说 (闭式壬硼烷阴离子),它是由 的盐在高温下分解得到的( 由 不对称裂解得到,在上文已有提及):
(注:这个反应实际产物非常复杂,会副产 等)
阴离子 有两种结构,如下图(氢原子没有画出):
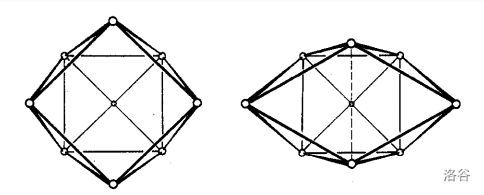
前者有 对称性,而后者有 对称性。经过计算发现,两种结构能量差很小且没有禁阻,故可以快速互变。
将 的盐溶解在 中,室温下通入空气,可以发现溶液逐渐变红,最后变成猩红色;继续通入空气一段时间,红色会逐渐变淡,并产生一种乳白色的沉淀。反应方程式如下:
反应会经历一种自由基阴离子中间体(),这种中间体是体系显示猩红色的原因。实际上,中间体到产物的转化通常不完全,所以到反应结束后常常还能分离出一点 的盐——这也是已知不多的自由基阴离子盐。
让我们回到反应产物 (闭式戌硼烷阴离子)上来。这个阴离子对称性也不高(结构如下图,氢原子没有画出),因此性质也不太稳定。如果在上面的反应中通入氧气的时间太长,那么 会被继续氧化。
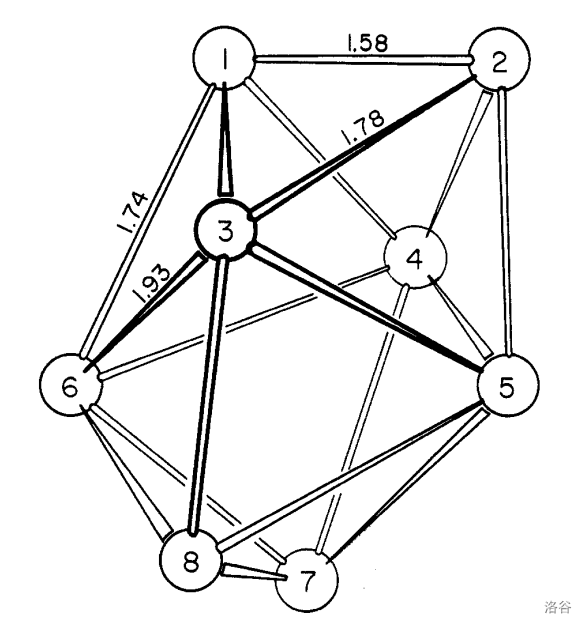
被继续氧化的产物之一是 (闭式庚硼烷阴离子)。这个阴离子的性质更不稳定(在闭式硼烷阴离子中稳定性垫底),容易被氧化,还容易水解。实验表明该阴离子有 轴, 个硼原子在一个球面上,如下图:

碳硼烷与碳硼烷阴离子
在硼烷的各种五花八门的衍生物中,碳硼烷是最具代表性的之一。这类物质有硼烷(或硼烷离子)的骨架,但一些硼原子被碳原子取代。碳原子上多出来的那个价键也可以连接有机基团,但由于这些取代碳硼烷的数量过于庞大,我们今天就暂且不讨论这些东西了,只看看那些“纯种”的碳硼烷。
二碳代十二硼烷(12)()是最稳定、重要的碳硼烷之一。细心的读者可以发现,这东西实际上就是 的等电子体。这种物质的基本结构也是正二十面体(实际上,由于碳的取代,会稍微“不正”一点),但由于碳的取代,会产生三种异构体。最容易得到的是 异构体(邻二碳代十二硼烷(12)),结构如下:

在这种结构中,两个碳原子在相邻的位置。制备这种物质一般从 开始,在 催化下与乙炔作用:
(注:如果换成取代的炔烃,就可以得到取代的碳硼烷)
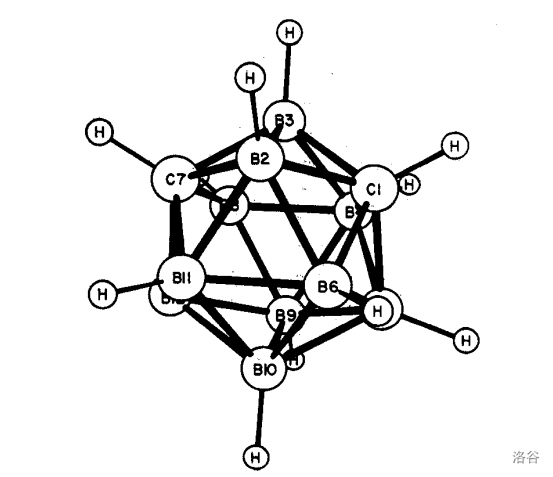
加热这种 异构体,在 左右会发生分子内的重排反应,得到间二碳代十二硼烷(12)(异构体)。其结构就是把上面那个分子中 号位的 原子换到 号位:
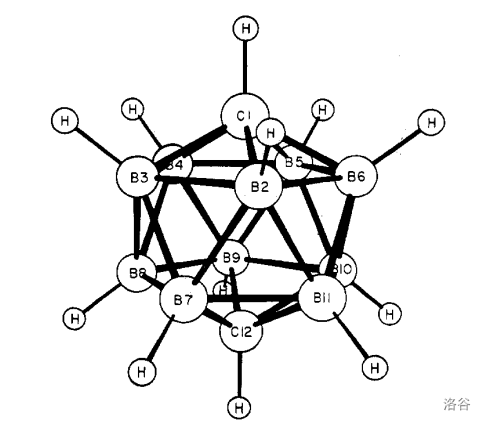
继续加热这种物质,最终会得到 异构体(对二碳代十二硼烷(12))。显然,碳原子处在对位是最对称的,因此它也是三种异构体里最稳定的,如下:
它们的生成焓数据证实了它们的稳定性次序。如下表:
| 碳硼烷 |
化学式 |
生成焓 |
| 邻二碳代十二硼烷(12) |
|
|
| 间二碳代十二硼烷(12) |
|
|
| 对二碳代十二硼烷(12) |
|
|
在乙醇中被强碱降解,可以得到 离子。继续用更强的碱处理这个离子,它还可以被进一步夺取电子,生成 :
它们的结构都是一个被抠掉一个顶点的二十面体(如下图)。比较有意思的是后者位于开口面上的 个原子各有一个 轨道指向上方中心,这五个轨道里的五个电子加上其中一个外来电子共同构成了一个 的大键,与环戊二烯负离子()差不多。
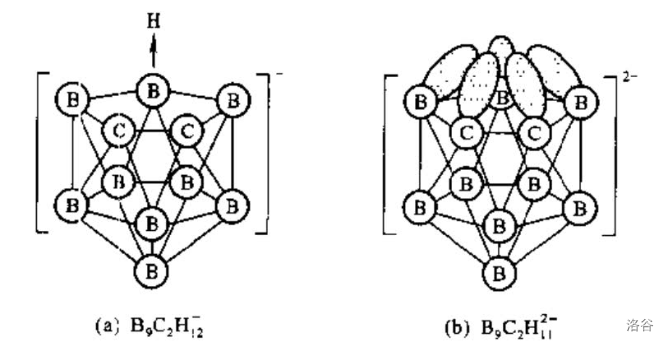
这个离子另一个与 类似的地方是,它可以形成类似于二茂铁()的夹心配合物,在此不做详述。
提到碳硼烷,还有一个不得不讲的东西:碳硼烷酸。这个名词其实并不特指某个酸,而是一类拥有卤代碳硼烷结构的酸的总称。它们中的大部分都是强酸、超强酸(注:指质子酸,而非路易斯酸),并包括有目前(截至 年)已知最强的单体酸()和已知最强的混酸()。
或许你会问:目前最强的不应该是氟锑酸()吗?如果你在 年之前持有这个观点,那显然是正确的——可是,时代已经变了。
我们先来看看最强的单体酸——十一氯碳硼烷酸()。它结构如下,主体是一个由 个硼原子和 个碳原子构成的正二十面体,起酸性作用的那个氢原子靠着一根键(还有一个极弱的氢键)与氯原子藕断丝连:
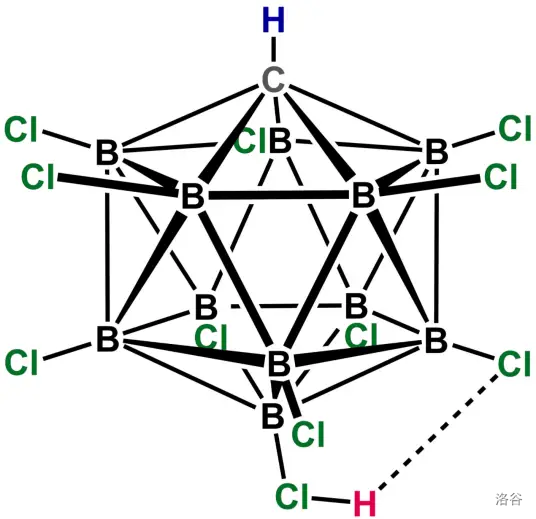
它的酸性是浓硫酸的一百万倍,氟磺酸的数百倍。它之所以酸性这么强,是因为其共轭碱()极其稳定,因此有非常强烈的去质子倾向。
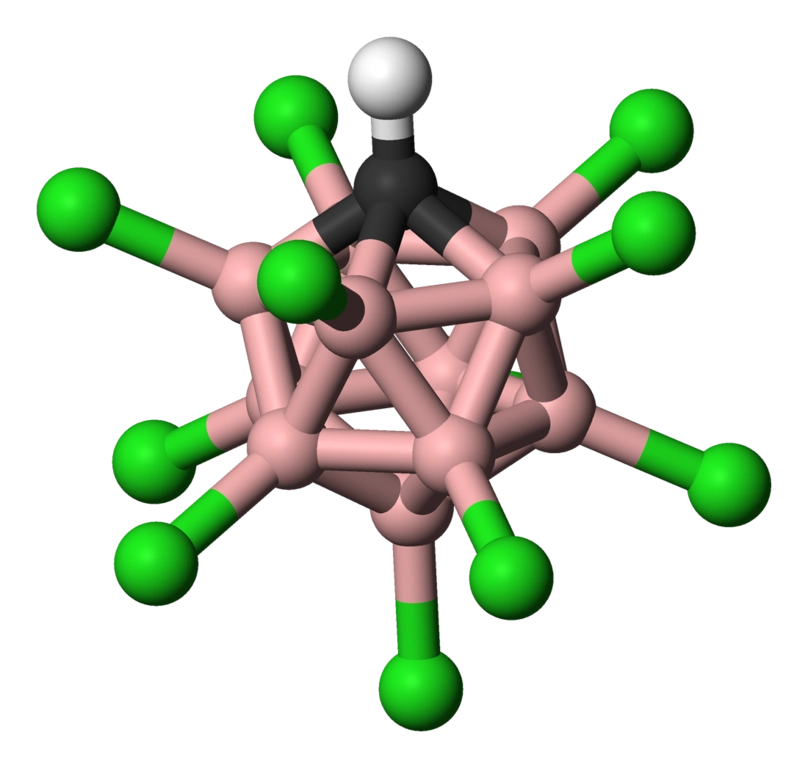
(上图: 的结构)
虽然酸性很强,但是这种酸是可以制出纯酸的。它有一个特殊的优点,就是酸性非常“纯正”(人话:不具强烈的腐蚀性与氧化性)。因此,用它来质子化通常副产物更少。比如,它可以在不破坏其主体结构的情况下为 赋予质子,以几乎定量的产率得到盐 。
但是,它还不是碳硼烷酸的巅峰。 年,人们用 替代所有的 ,得到了已知最强的混酸——十一氟碳硼烷酸()。它的酸性远超过了魔酸(),甚至超过了曾经的最强——氟锑酸()!证据表明,这种酸可以非常快的为 甚至是稀有气体 赋予质子,得到下面这些奇异的物种:
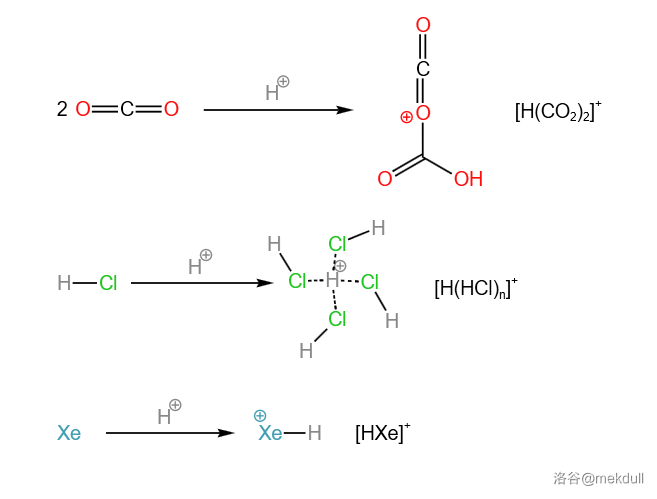
显然,氟磺酸没有为这些物种赋予质子的能力。
虽然碳硼烷酸非常强大,但至少目前,它还没有得到广泛的应用。其中一个重要原因是其复杂、繁琐的制备方法。由于中文互联网上几乎没有碳硼烷酸的合成资料,所以这里简单地过一遍 的合成。制备还是从癸硼烷()开始,在水中它与 反应,得到 ,随即在酸性条件下得到 :
后者的结构如下():
随后, 被硫酸二甲酯甲基化,得到 。该物质在 中被碱金属还原,得到 的盐(副产 ):
接着,高温分解 的盐,即可得到 离子(结构如下,省略氢原子),也就是碳硼烷酸的内核:
最后一步就是在纯醋酸中直接氯化该离子,即可得到十一氯碳硼烷酸的阴离子 。至于最终制出纯酸,还需要两步,在此简单提及一下:先制出十一氯碳硼烷酸三甲基硅(,阳离子可以通过重排反应等方法得到),由于 是极强的路易斯酸,所以该物质与 反应就可以得到 。
硼烷的其他秘密
正如你所见,我们在上面已经讨论了很多硼烷(及其衍生物)的结构和性质,但这也只是硼烷世界的冰山一角。它身上还有很多秘密没有揭开,比如,为什么硼原子可以形成这么古怪的化学键?是不是只有硼原子拥有这项“神技”?
我们可以从硼原子的结构上找线索。前面已经提到,硼是缺电子元素,外层三个电子即使全部成键也到不了 稳定结构,而硼原子原子半径又比较小,电负性比较大,也没有直接扔掉 个电子的理由。或者换一种更新的解释,硼的 个轨道成键后留下一个空轨道,如果这个轨道不被利用起来,那它就会吸引周遭的成键电子,最终的结果就是这个轨道也被组合进了整体的分子轨道内。
现在我们反观硼在元素周期表上的位置,就会发现,这一切其实都是元素周期律带来的命中注定。再也没有一种元素像硼一样,身为非金属,但外层电子小于稳定构型所需电子数的二分之一(硼:);而它同族的其他元素都是金属。又由于外层电子少,所以它难以直接得到所需的所有电子,因此它与金属形成的二元化合物绝大多数都非常古怪(比如与 元素的化合物 等)。

(上图: 制作的器件实物)
总的来说,硼与其他非金属都很不同,反而更像某些重过渡系金属。但它的位置,却又在周期表的很前面……
但如果要说这是硼元素的独门秘籍,那也大可不必。就不说 这些与它离得很近的元素了吧(因为前面其实说过了),下面这个重金属 的化合物()也拥有奇特的氢桥键:

不管怎么样,其实这些问题的底层就一句话:这样成键的能量更低。所谓“奇怪”只是我们的一面之词,物质才不会管这样成键是否“古怪”。
下一个问题也是很多人感兴趣的:硼既然能形成这么多复杂的氢化物,那么它可以成为生命的核心元素吗?即,所谓硼基生命是否可能存在?
对于这个问题,我只能说:如果只基于人类目前的化学知识,那么有且只有碳可能成为生命的核心,这是毫无疑问的。生物学上,地球上已发现的一切生命都是碳基生命;化学上,确实有以 等元素为核心的复杂化合物,但是这个“复杂”与蛋白质、核酸这些东西相比,简直是过于微不足道了。
但是,我们不能就此否认这种可能性。说不定以 为核心的生命是可能存在的,只是我们还没发现罢了。而且,我们也不是没有支持这一观点的证据。硼氢化学直到今天都是非常活跃的化学领域,而在最近更是衍生出了“超级硼烷”的概念。下图是某个已经成功合成的超级碳硼烷(化学式:,分子量约为 万)的两种结构(省略氢原子,灰色为 原子,粉色为 原子):

只能说,面对这些物质,我们仍然知之甚少。谁能知道它们之中还隐藏了多少秘密?这个曾经碾碎我们常识的元素,直到现在也不肯透露它最神秘的一面。而对于硼是否能成为生命核心元素这个问题,自然也是难下定论。但就我自己而言,我还是愿意相信这种可能。
在讨论完这几个问题之后,这篇杂谈也临近尾声了。我一直很喜欢硼,喜欢它打破常规,千变万化,但令我失望的是,这个元素最奇妙的一类化合物——硼烷,在中文互联网上却资料寥寥(新闻报道倒是有一堆,但都没有什么真知识)。于是我写下了这篇文章,希望能对你有所帮助。我会把参考资料列在下面,如果有需要可以进一步了解。
参考资料
论文类
:Lambert J B, Zhao Y. The trimesitylsilylium cation[J]. Angewandte Chemie International Edition in English, 1997, 36(4): 400-401.
:Reed C A. The silylium ion problem, R3Si+. Bridging organic and inorganic chemistry[J]. Accounts of chemical research, 1998, 31(6): 325-332.
:Bhattacharya D, Klein D J, Oliva J M, et al. Icosahedral symmetry super-carborane and beyond[J]. Chemical Physics Letters, 2014, 616: 16-19.
:Bohn R K, Bohn M D. Molecular structures of 1, 2-, 1, 7-, and 1, 12-dicarba-closo-dodecaborane (12), B10C2H12[J]. Inorganic Chemistry, 1971, 10(2): 350-355.
:Burg A B, Kratzer R. The Synthesis of Nonaborane, B9H15[J]. Inorganic Chemistry, 1962, 1(4): 725-730.
:Dickerson R E, Wheatley P J, Howell P A, et al. Crystal and molecular structure of B9H15[J]. The Journal of Chemical Physics, 1957, 27(1): 200-209.
:Dobrott R D, Friedman L B, Lipscomb W N. Molecular and crystal structure of B20H16[J]. The Journal of Chemical Physics, 1964, 40(3): 866-872.
:Graybill B M, Pitochelli A R, Hawthorne M F. The preparation and reactions of B10H13 (Ligand) anions[J]. Inorganic Chemistry, 1962, 1(3): 622-626.
:Juhasz M, Hoffmann S, Stoyanov E, et al. The strongest isolable acid[J]. Angewandte Chemie International Edition, 2004, 43(40): 5352-5355.
:Kasper J S, Lucht C M, Harker D. The crystal structure of decaborane, B10H14[J]. Acta Crystallographica, 1950, 3(6): 436-455.
:Klanberg F, Muetterties E L. Chemistry of boranes. XXVII. new polyhedral borane anions, B9H92-and B11H112-[J]. Inorganic Chemistry, 1966, 5(11): 1955-1960.
:Klanberg F, Eaton D R, Guggenberger L J, et al. Chemistry of boranes. XXVIII. New polyhedral borane anions, B8H82-, B8H8.-, and B7H72[J]. Inorganic Chemistry, 1967, 6(7): 1271-1281.
:Knoth W H. 1-B9H9CH-and B11H11CH[J]. Journal of the American Chemical Society, 1967, 89(5): 1274-1275.
:Knoth Jr W H. B10H12CNH3, B9H9CH-, B11H11CH-, and metallomonocarboranes[J]. Inorganic Chemistry, 1971, 10(3): 598-605.
:Reed C A, Z W Xie, Bau R, et al. Closely approaching the silylium ion (R3Si+)[J]. Science, 1993, 262(5132): 402-404.
:Reed C A. Carboranes: A new class of weakly coordinating anions for strong electrophiles, oxidants, and superacids[J]. Accounts of chemical research, 1998, 31(3): 133-139.
:Reed C A, Kim K C, Bolskar R D, et al. Taming superacids: Stabilization of the fullerene cations HC60+ and C60·+[J]. Science, 2000, 289(5476): 101-104.
:Jelínek T, Plešek J, Heřmánek S, et al. Chemistry of compounds with the 1-carba-closo-dodecaborane (12) framework[J]. Collection of Czechoslovak chemical communications, 1986, 51(4): 819-829.
:Z W Xie, Tsang C W, Sze E T P, et al. Highly chlorinated, brominated, and iodinated icosahedral carborane anions: 1-H-CB11X11-, 1-CH3-CB11X11-(X= Cl, Br, I); 1-Br-CB11Br11[J]. Inorganic chemistry, 1998, 37(25): 6444-6451.
丛书类
(1)《硼氢化合物》,郑学家主编,化学工业出版社
(2)《无机化学》(第五版),北京师范大学,华中师范大学,南京师范大学合编,高等教育出版社
(3)《无机化学》(第二版),张祖德主编,中科大出版社







































