谨以此文,纪念“有机合成之父”罗伯特·伯恩斯·伍德沃德()逝世四十五周年。
注:如果本文中有任何错误或疏漏,请务必联系作者或在评论中写出。不胜感谢!
1.前情提要
相信应该没有人不曾听闻过这类被称为叶绿素()的物质。作为这个星球上光合作用的核心,这类外表看上去毫不起眼的色素支撑起了整个仰赖阳光的生态系统,并在几亿年来一直庇佑着其下的生灵,可谓是生命在进化过程中最伟大的创造之一。

(上图:一大堆叶绿素实物)
而在叶绿素中,最引人注目的当属叶绿素A。作为绝大部分植物光合作用的作用中心色素,叶绿素A分子是将光能转化为化学能的最重要一环。它的分子结构如下图所示,具有一个标志性的卟啉环,中心还有一个配位的 离子:
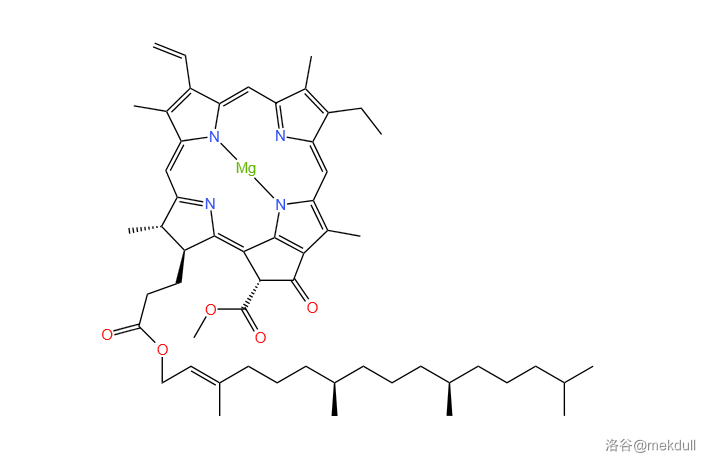
(勘误:上图中少画了两个 的配位键,在此改正)
叶绿素A天然存在于植物细胞叶绿体中的类囊体膜上,与蛋白质结合在一起。它的分子式为 ,相对分子量接近 。人们光是鉴定它的真实结构就花了超过 年的时间,耗尽了一代有机化学家的心血。叶绿素A的完整结构在 年被彻底破解,当时就有人断言:这么复杂的分子已经远远超越了有机化学的极限,人类不可能合成。
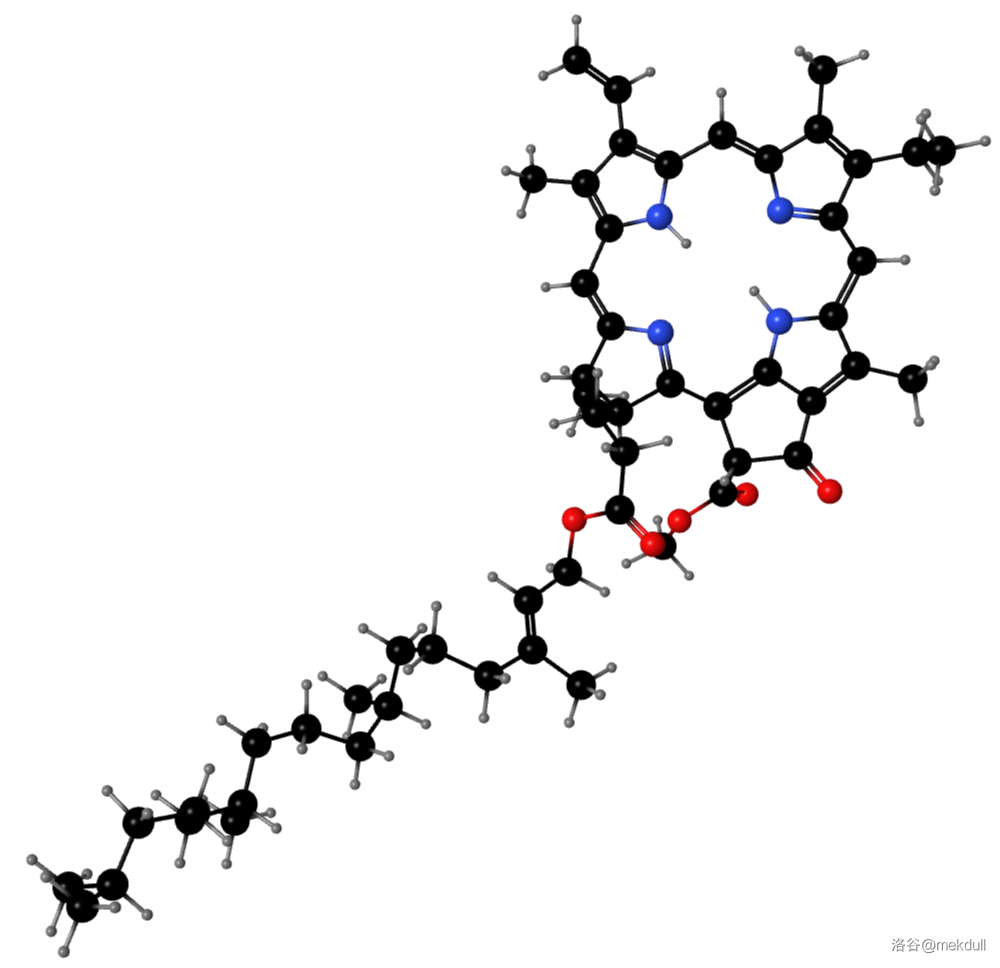
(上图:去镁叶绿素A的球棍模型,由计算机渲染得到)
的确,以当时( 世纪中期)的有机化学水平和思想,合成叶绿素A像是天方夜谭。没有人敢尝试攀登这座高峰,即使是仰望之都令人生畏。就连叶绿素A结构的最终破译者之一, 都认为,合成这种物质的妄想实在是太疯狂了。
然而就在此时,一位天才站了出来。他首先在 年完成了奎宁()的全合成——在此之前,奎宁也被认为是人类不可能合成的物质。在这之后的十几年,他和他的团队又接连攻克了胆固醇()和可的松()的全合成。 年,他又做出了一个重大决定——向叶绿素A的全合成冲锋。
他就是近代有机合成之父,“有机合成艺术家”,罗伯特 · 伍德沃德()。

年之后,一篇标题简洁的论文震惊了整个化学界。

(上图:《叶绿素的全合成》论文影,,伍德沃德)
在下文中,我们将会详细讨论这条合成路线。需要提醒的是,那个年代的有机合成方法还远没有现在那么发达,很多重要的 键构筑方法(比如 反应、 催化的偶联反应)还没有出现。但是,我们也必须承认,伍德沃德把那些看似简单的反应发挥到了一个新的高度,这也使得整条合成路线更像是精美的艺术。
2.概述
叶绿素A其实是一个非常脆弱的分子。很早之前就有人发现,只需 的些许变化就可以使它的颜色由绿色变成褐色(实际上是因为中心的 游离出配位体系),而且在有些时候这种变化还是不可逆的。这个分子热稳定性也很差,温度高一点就会原地分解。因此,在合成过程中反应条件必须十分温和。
仔细观察叶绿素A分子,我们还会发现它的卟啉环系有缺陷。如下图,相比于正常的卟啉,叶绿素A的 号位碳原子上各多了一个氢——这使得这两个碳原子具有手性,并且在 位还稠合了一个五元环。考虑到当时的手性合成方法还很不成熟,这无疑将成为合成中最大的难点之一:
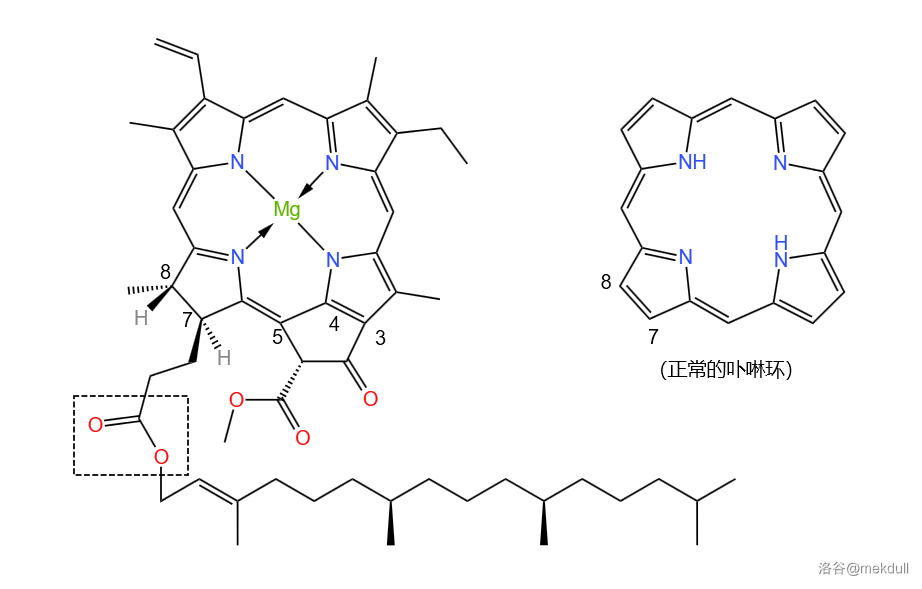
上图中还用方框框出了分子左下角的一个酯结构。这个酯对应的醇称为叶绿醇(又称植醇),它在 年被 等人首次合成。下图中展示的叶绿醇合成路线是经过后人多次改良过后的:
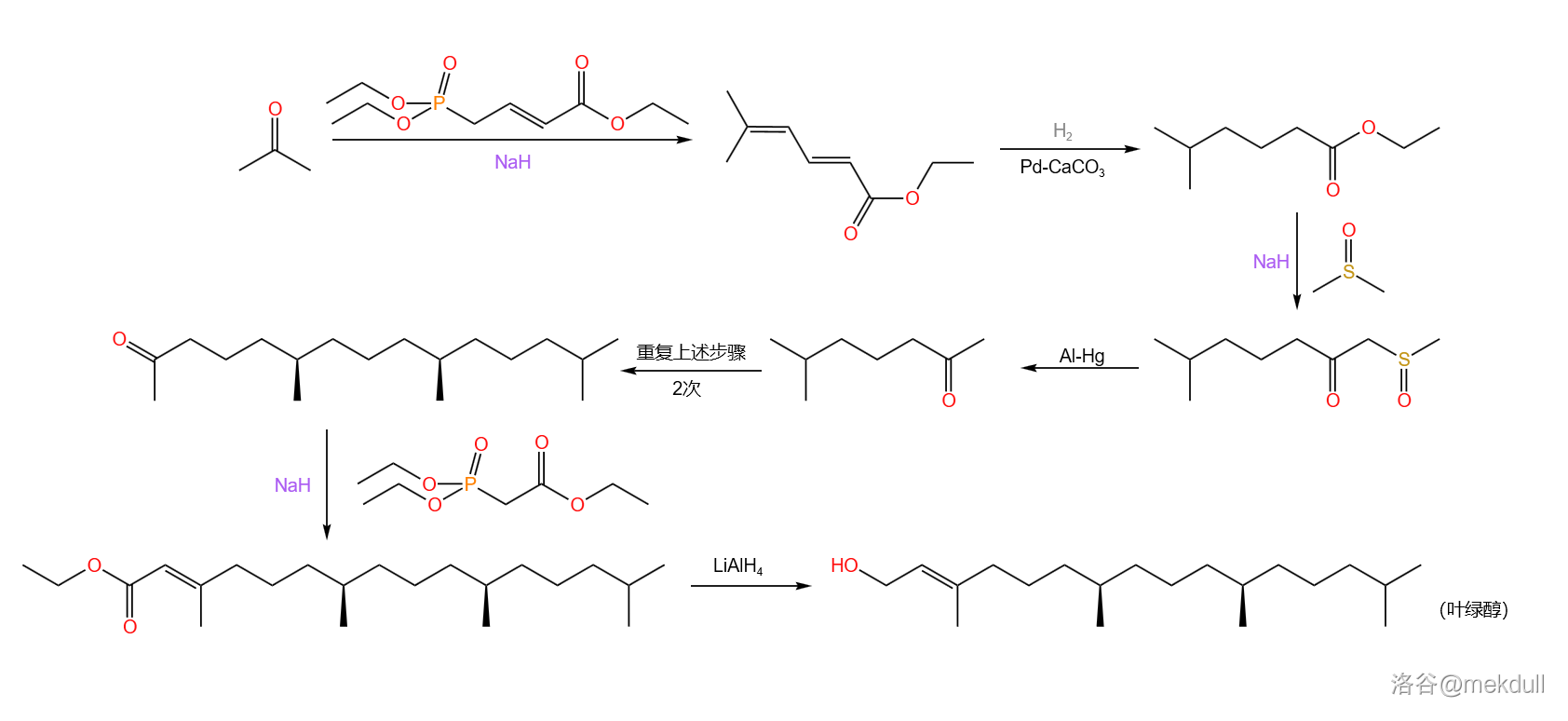
现在我们有了叶绿醇,但别急,这还只是一个支链结构的一部分。主体的卟啉结构,在伍德沃德那个年代还没有人成功合成过——况且还有一堆支链和那个讨厌的缺陷。我们必须从头发展一种合成卟啉衍生物的方法——这才是全合成叶绿素面对的最大困难,也是最精彩的部分。
本文中涉及的主要有机反应清单:
-
酰基化;
-
逆 缩合;
-
消除;
-
缩合;
-
酯交换反应
核心: 卟啉合成反应。
3.逐步合成分析
伍德沃德首先将整个分子切成了 块,如下图。在这之中有 个砌块(编号 ),它们都是吡咯的衍生物,也是卟啉环的主要组成部分。合成的总体思路为:先用缩合反应拼接起整个卟啉环系,然后进行一些修饰,最后把叶绿醇( 号砌块)拼接上去,完成整个全合成:
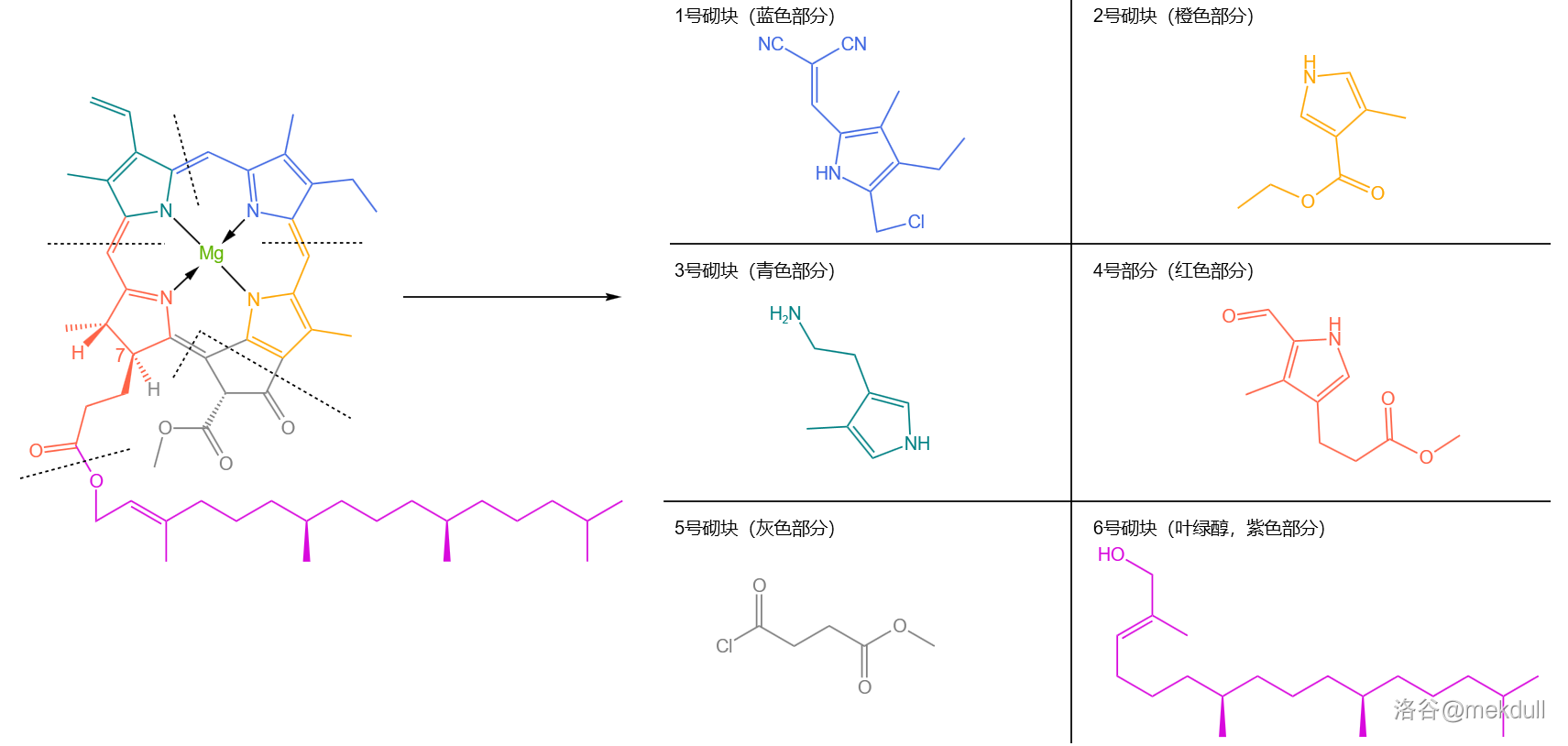
接下来,请坐好抓稳,全合成的介绍即将正式开始。
3.1 卟啉环的拼接
首先, 号砌块与 号砌块在乙醇/水中加热缩合,得到二吡咯基甲烷(原文中就是这么称呼的)。显然,缩合可以发生在 号砌块的 两个位置,但实际得到的大部分是 号位缩合的期望产物,这主要是因为 号位连接了一个较大的基团导致 号位缩合空间位阻较大。没错,这个大位阻是课题组故意设计的,目的就是让期望产物的产率变高:
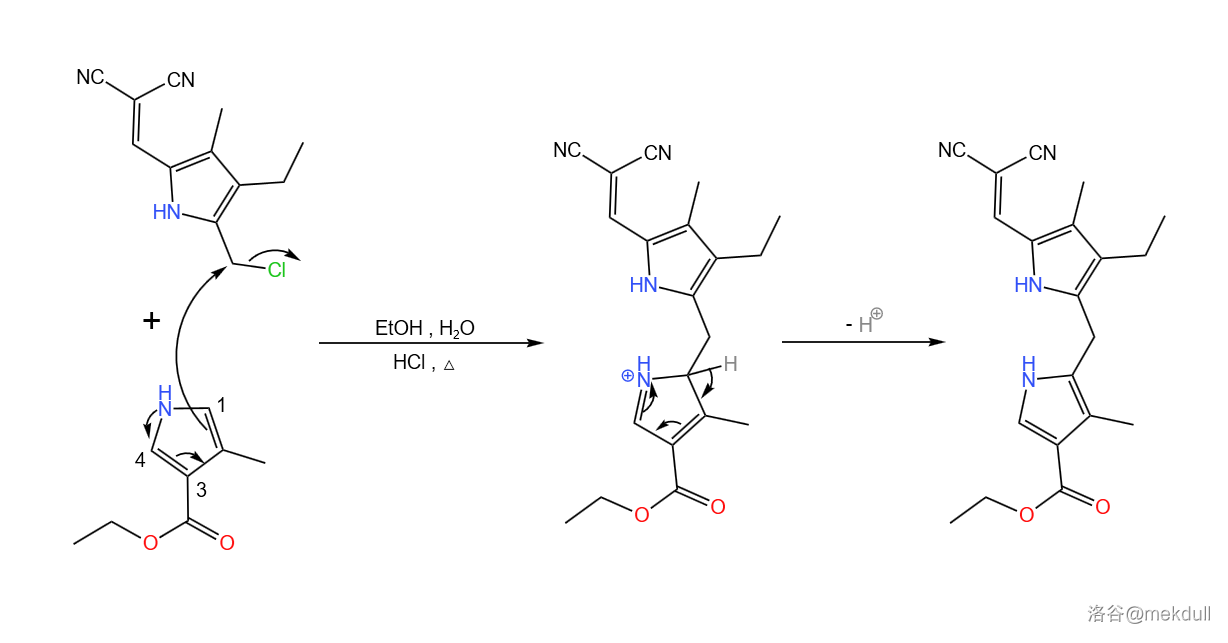
随后,在 的催化下,该物质与 号砌块发生 酰基化反应。由于此时吡咯环上只有 号位连接有 原子,所以可以得到单一产物:
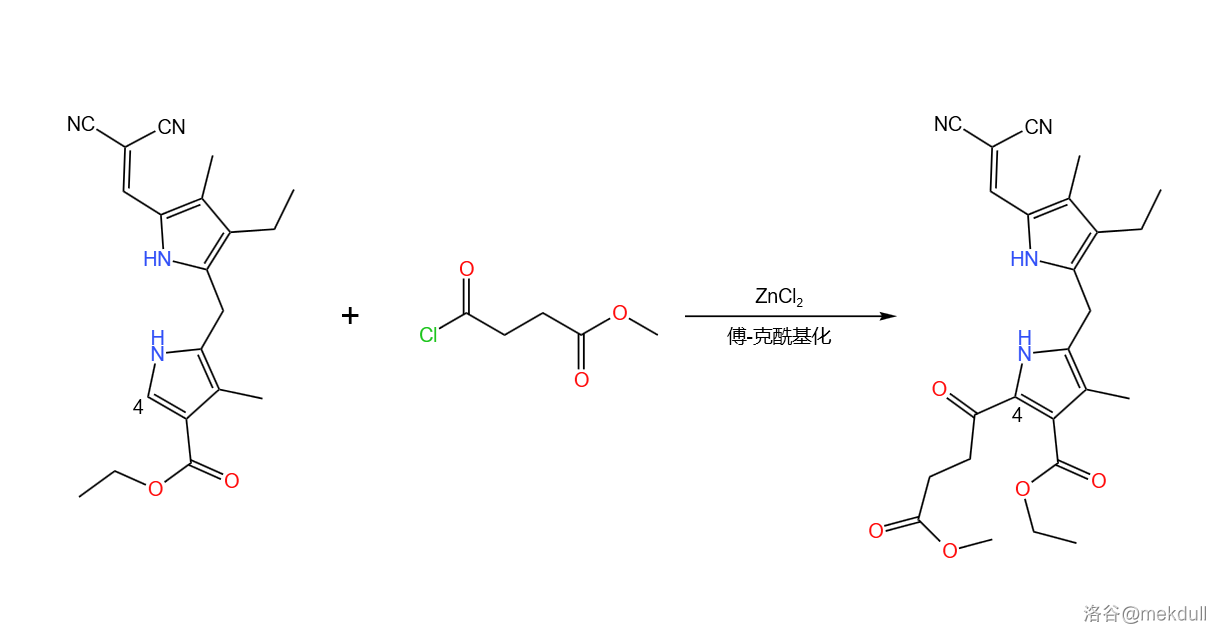
接着,该物质在热的 作用下发生逆 缩合反应,去除顶部的二氰亚甲基保护基(),游离出醛羰基,为下一步缩合做准备。与此同时,下方的两个酯基也被 脱去,因此还要使用甲醇()进行一步酯化:
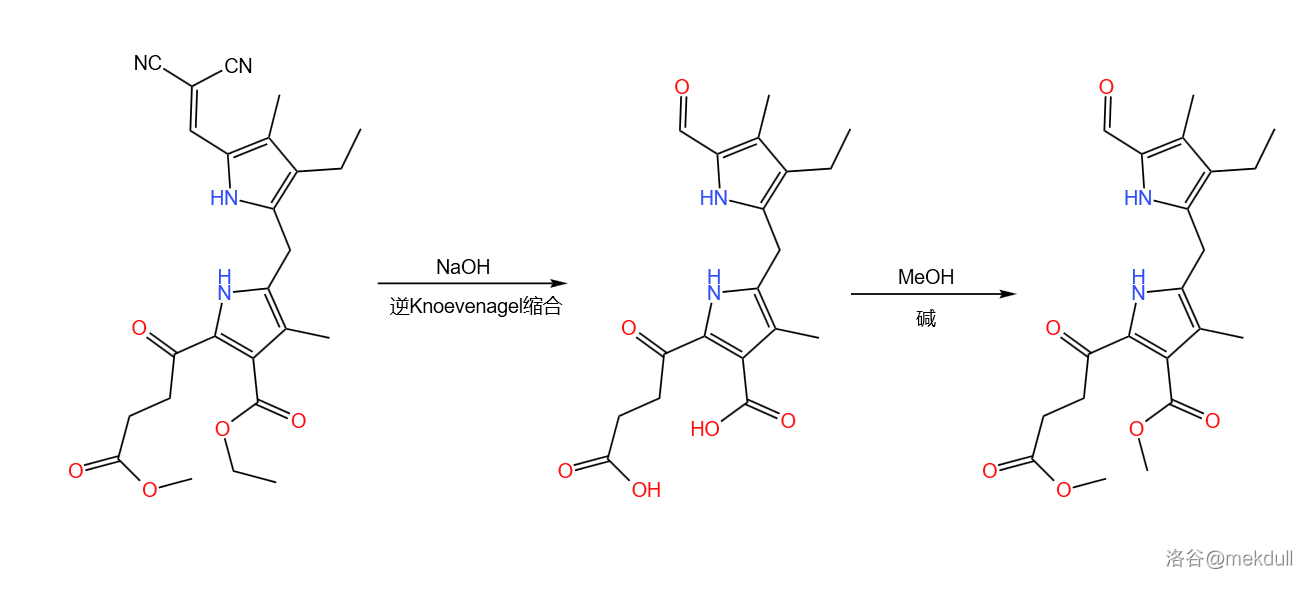
加热条件有助于 缩合的逆反应,即脱去活泼亚甲基化合物的反应进行。一般的 缩合需要脂肪族胺(比如哌啶)的催化(但在这里并不需要),机理如下:
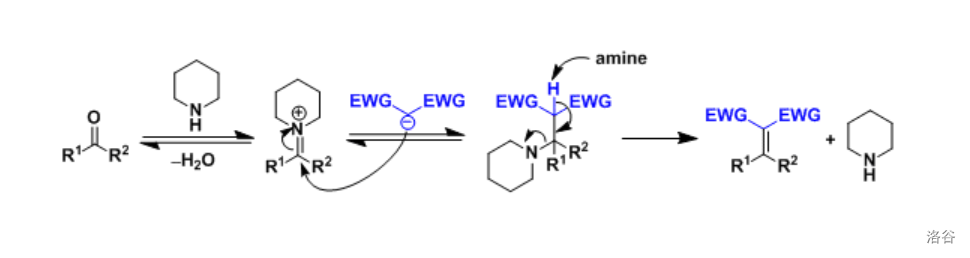
(注: 表示吸电子基团。)
回到正题,接下来是 号和 号砌块在水中缩合,随后又在酸作用下脱水,在 作用下还原得到二吡咯基甲烷:
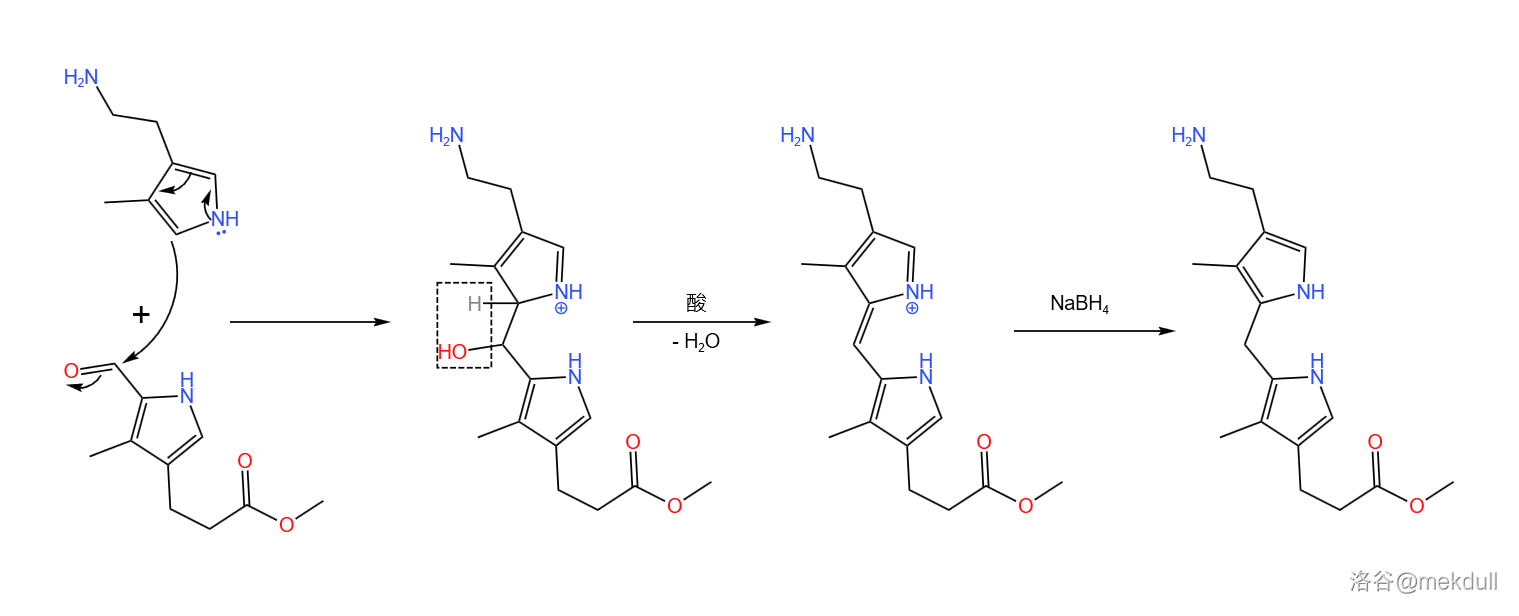
到这一步,卟啉环的左右两部分都已经准备就绪了,接下来就是把它们拼接到一起。可在这里,课题组却遇到了困难:这里的缩合可以得到两种产物,但只有一种是我们需要的。这无疑导致了原料的浪费和产率的降低,对于伍德沃德来说,这是一个不能容忍的问题。
要解决问题,首先要找到原因所在。观察这个反应可以发现:两种反应底物都是不对称的,在缩合成环过程中显然会存在两种取向,如下图。要想只获得期望产物,就必须控制反应的取向:
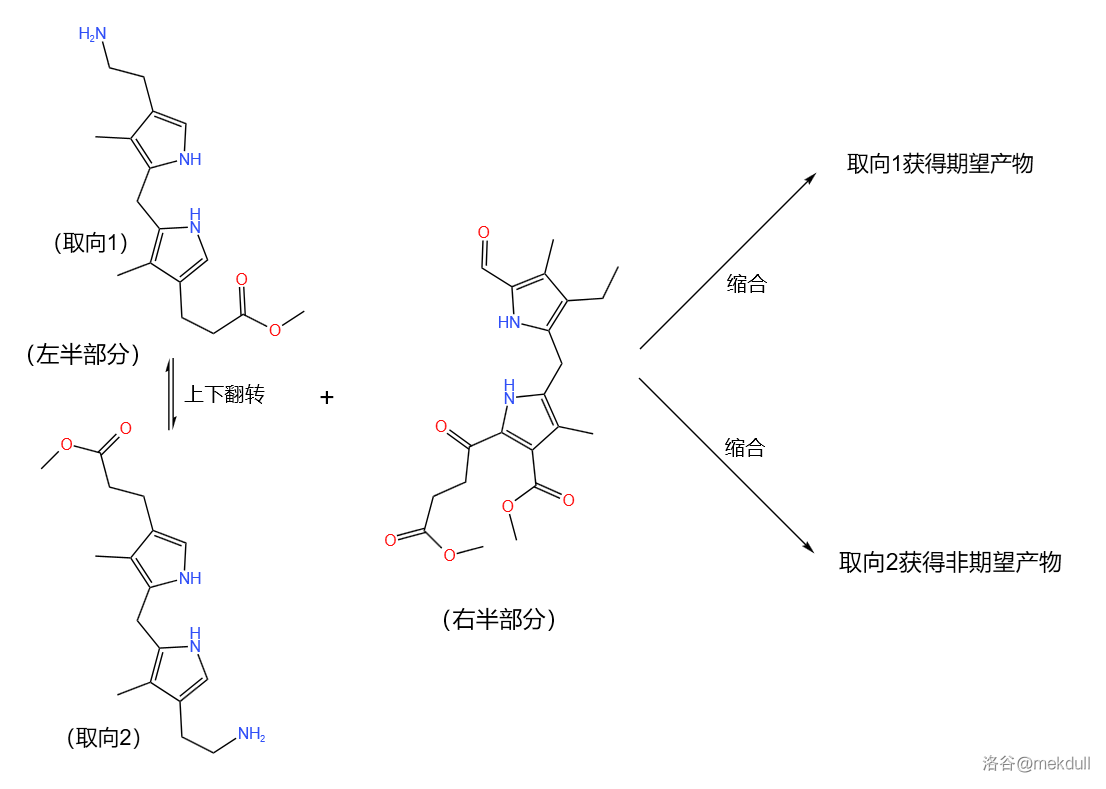
不对称导致的问题必须利用不对称才能解决,伍德沃德是这么说的。他注意到了右半部分参与缩合的有两个羰基,分别处于分子的 号位和 号位。关键是,这两个羰基里一个是醛羰基,另一个是酮羰基。由于空间位阻的原因,醛羰基一般比酮羰基更活泼。
于是,他将这个物质于 反应,果然只有 号位的醛羰基被取代了:
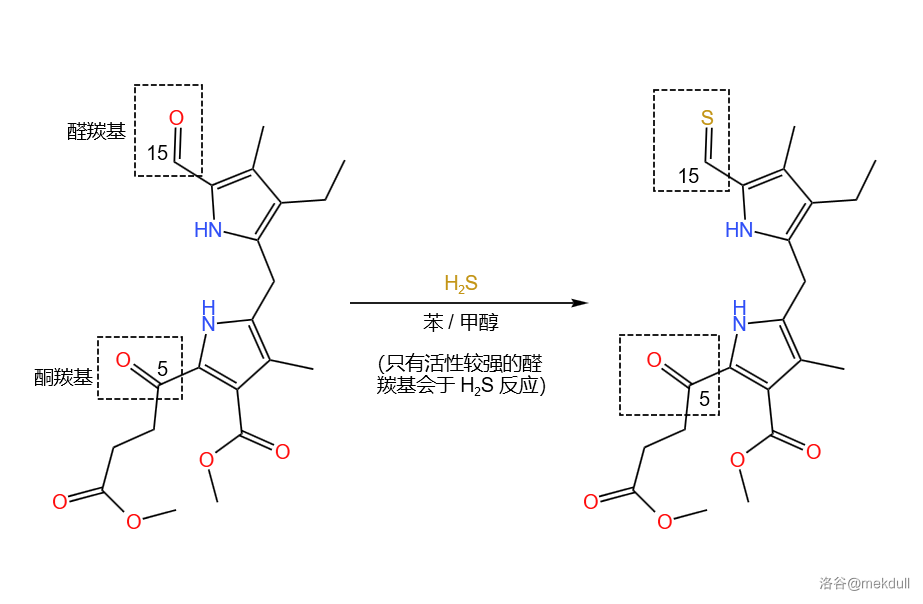
那这又有什么用呢?请先别急,好戏还在后面。我们先来对比一下 键和 键的差异,显然的是,后者键能更小,也更加活泼。再观察一下左半部分,可以看到 号碳原子上有一个氨基(,见下图)。没错,这也是一个刻意而巧妙的设计。
所以,当我们把处理过后的右半部分与左半部分反应时, 号碳原子上的氨基会优先与 位上的硫羰基()缩合,得到中间体席夫碱()。反应的取向就这样被固定了下来:
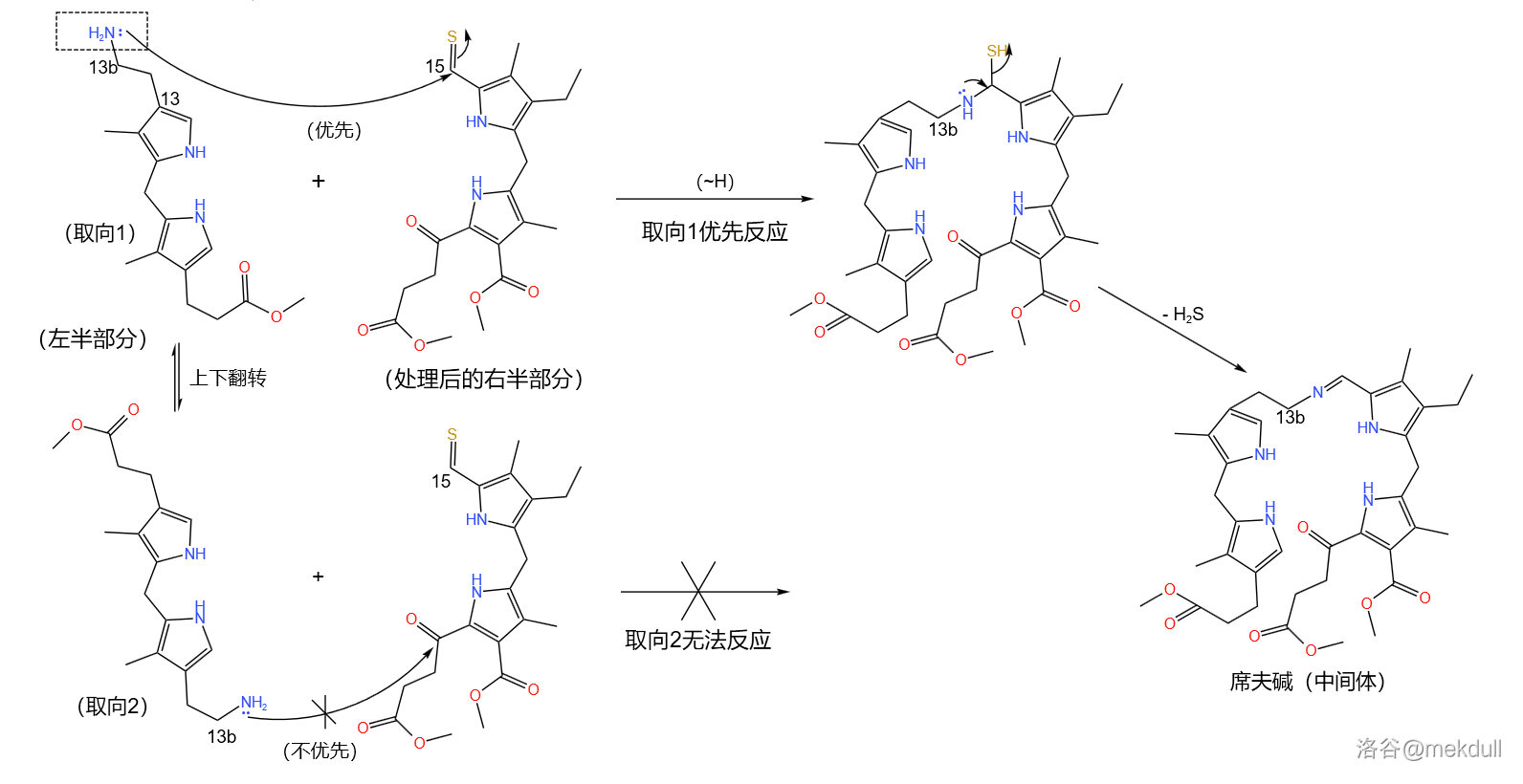
随后,该中间体再在 作用下环化缩合为卟啉(见下图)。这种方法后来发展为合成不对称卟啉衍生物的重要方法,即 卟啉合成反应。
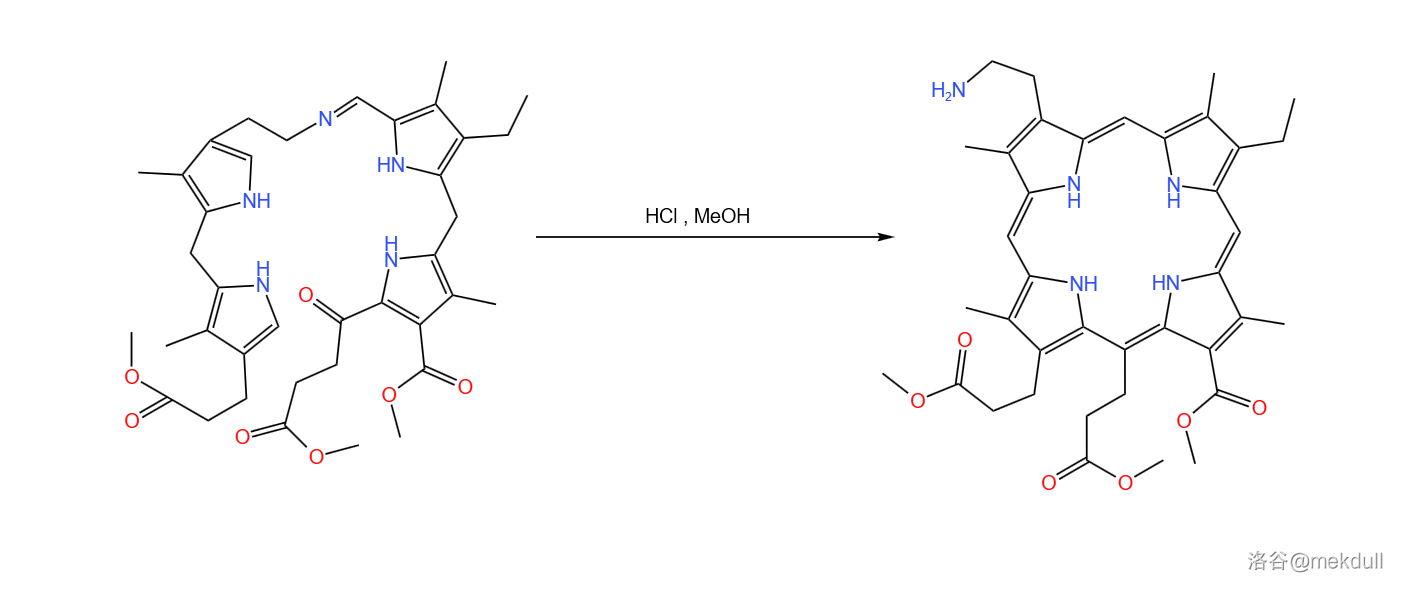
到这一步,我们就完成了整个卟啉环的拼接。
3.2 卟啉环的修饰
现在我们有了一个卟啉环,但距离成功还差很远。我们应该怎么去构造 位上的那个“缺陷”?那个稠合的五元环又怎么接上去?问题多得几乎无从下手。
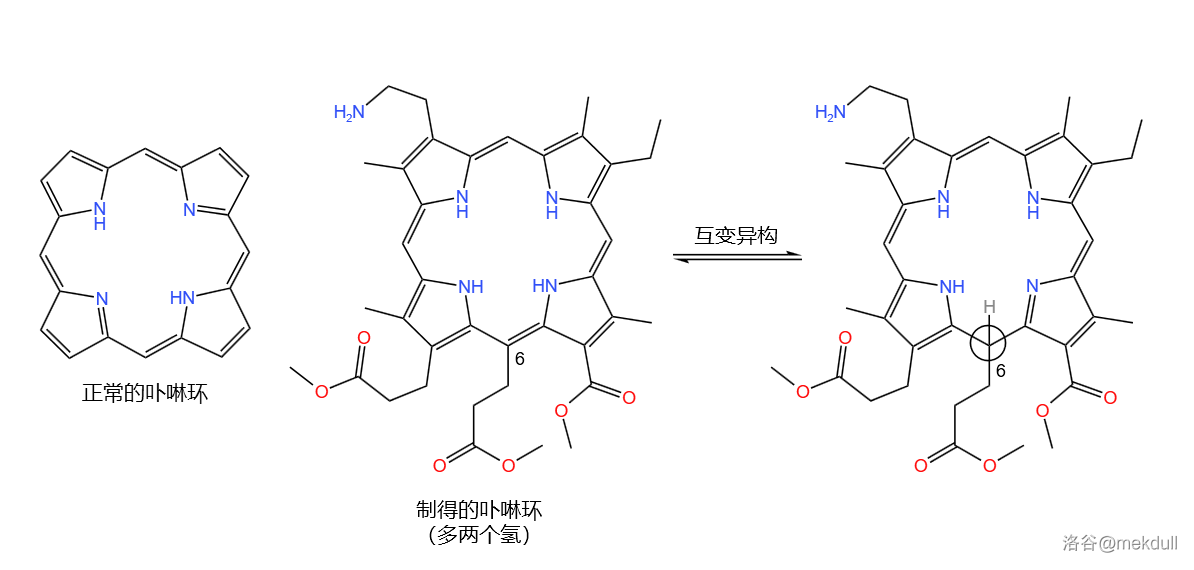
这个时候,伍德沃德采用了顺水推舟的方法。先把手中的东西全面检测一下,再做些实验看看它有什么性质,说不定就能从中获得灵感。他发现,我们得到的物质其实是一大堆互变异构体的平衡混合物,并且自带缺陷,相比于正常的卟啉环多了两个氢。
其中有一个占比较大的互变异构体引起了他的注意,如下图。它的 号碳原子是 杂化的,这直接阻断了分子内 电子的环流,使整体失去了芳香性:
伍德沃德猜想:这个碳原子上的氢应当容易被夺取。实验事实支持了他的猜想:这个物质容易被空气氧化。可空气的氧化性还是太强,会把其他部分也氧化掉,不如换个弱一点的?
最终,他选择了碘单质()做氧化剂,并高产率地得到了期望产物:
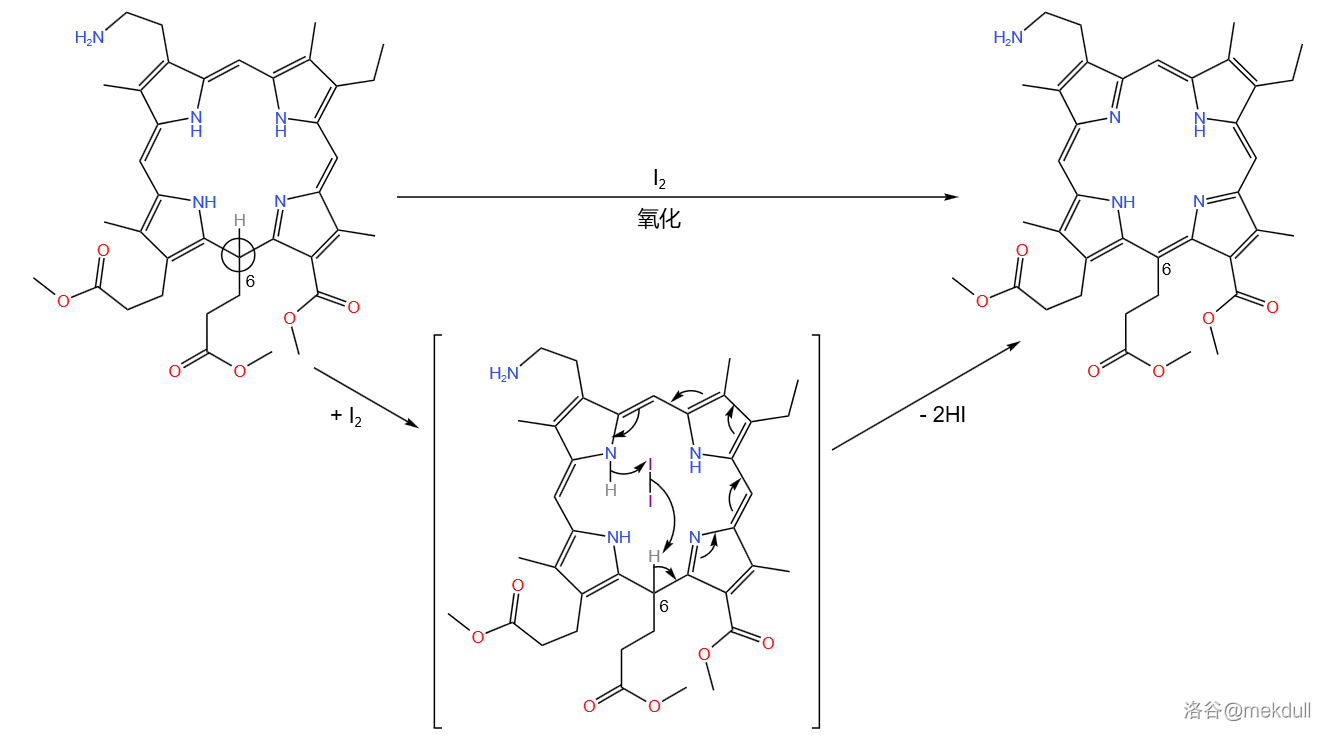
紧接着,再 的作用下, 号碳原子上的氨基被乙酰化保护:

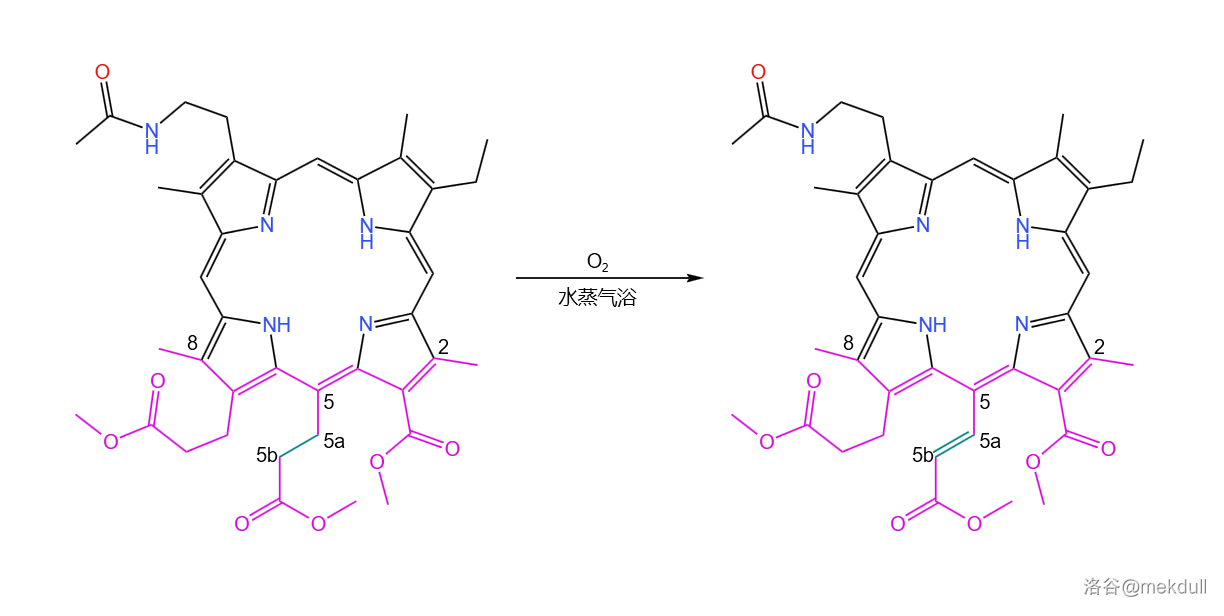
之所以要这么做,是因为伍德沃德准备要下一局大棋。他注意到分子的下半部分,也就是 号碳原子那儿(下图中紫色部分)其实是很拥挤的。这巨大的空间位阻甚至导致了整个卟啉环都为之变形。由此,伍德沃德推断,处于拥挤区域中心的 号碳原子(下图中用绿色标注)上的氢也是容易被夺取的。
果然,在水蒸气浴中该分子顺利地被空气氧化,得到了几乎定量的产物:
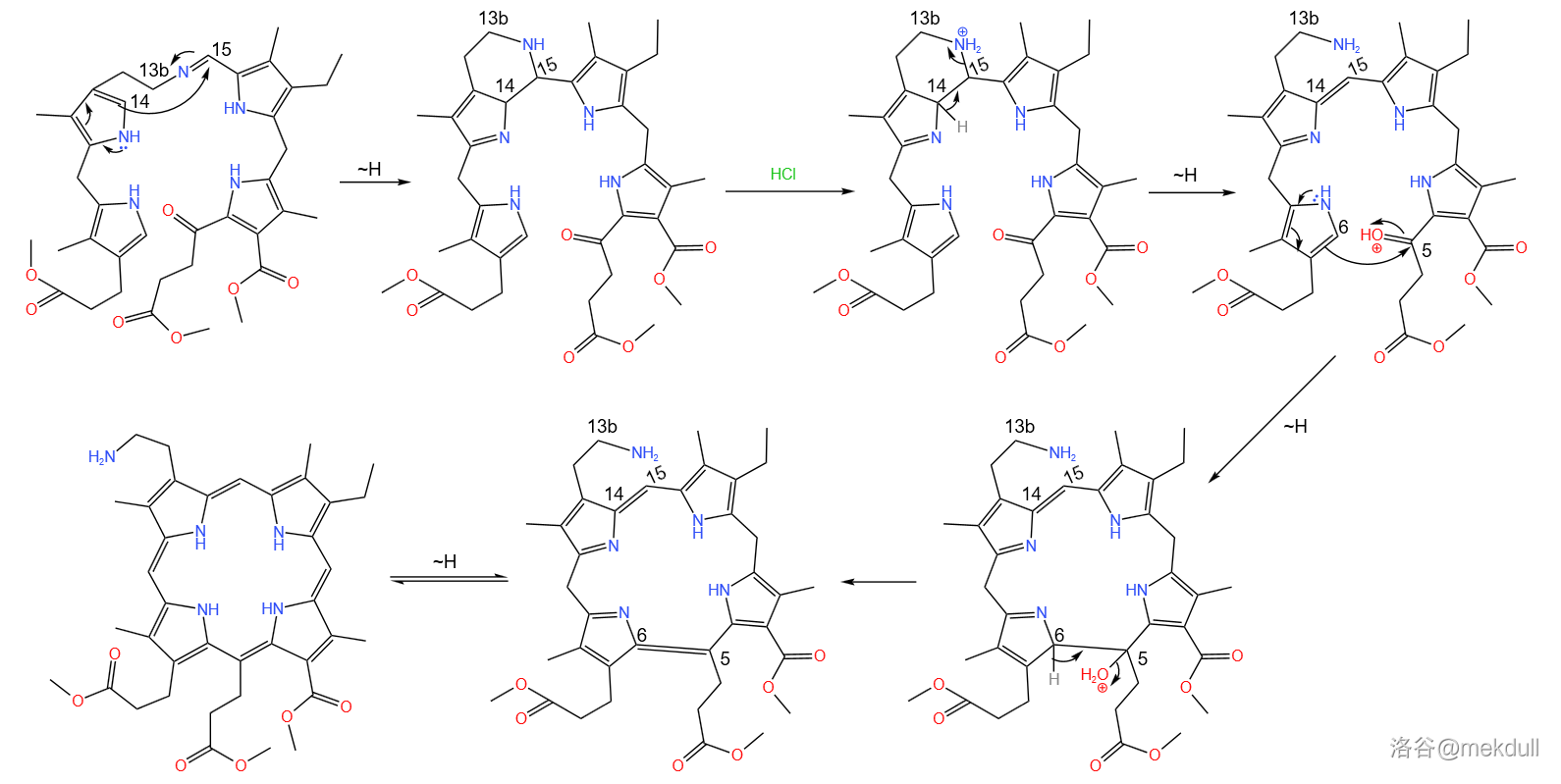
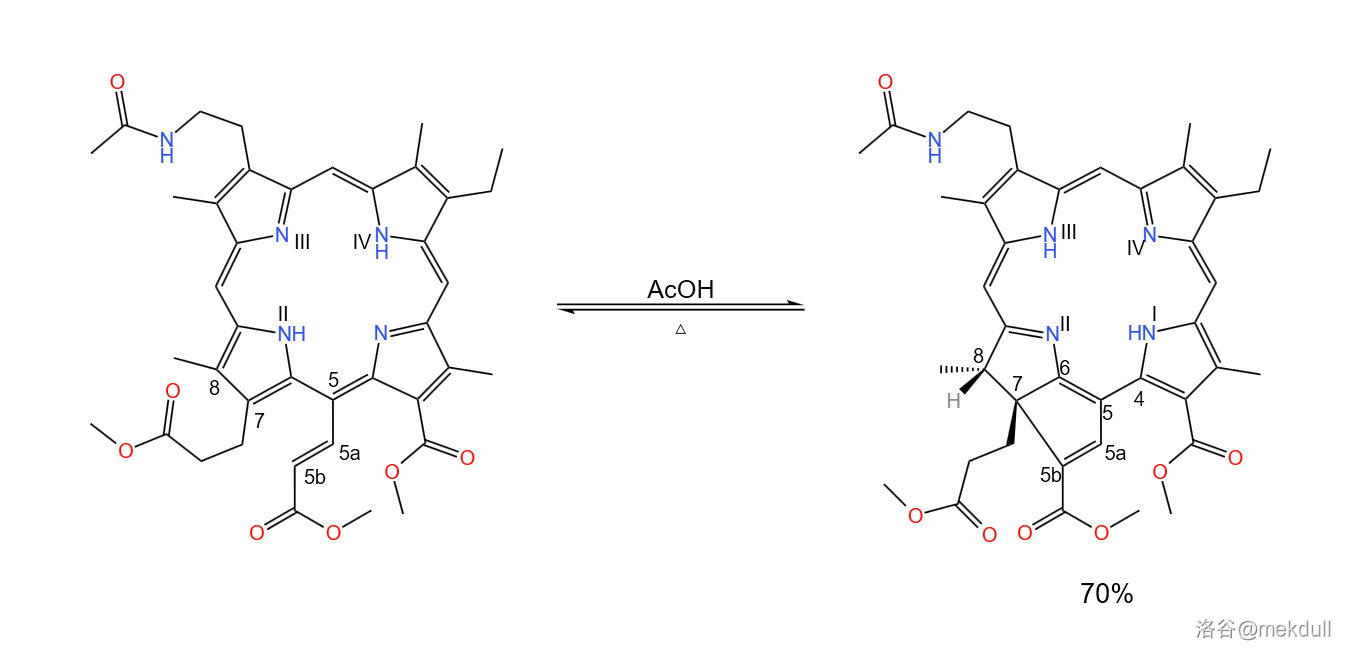
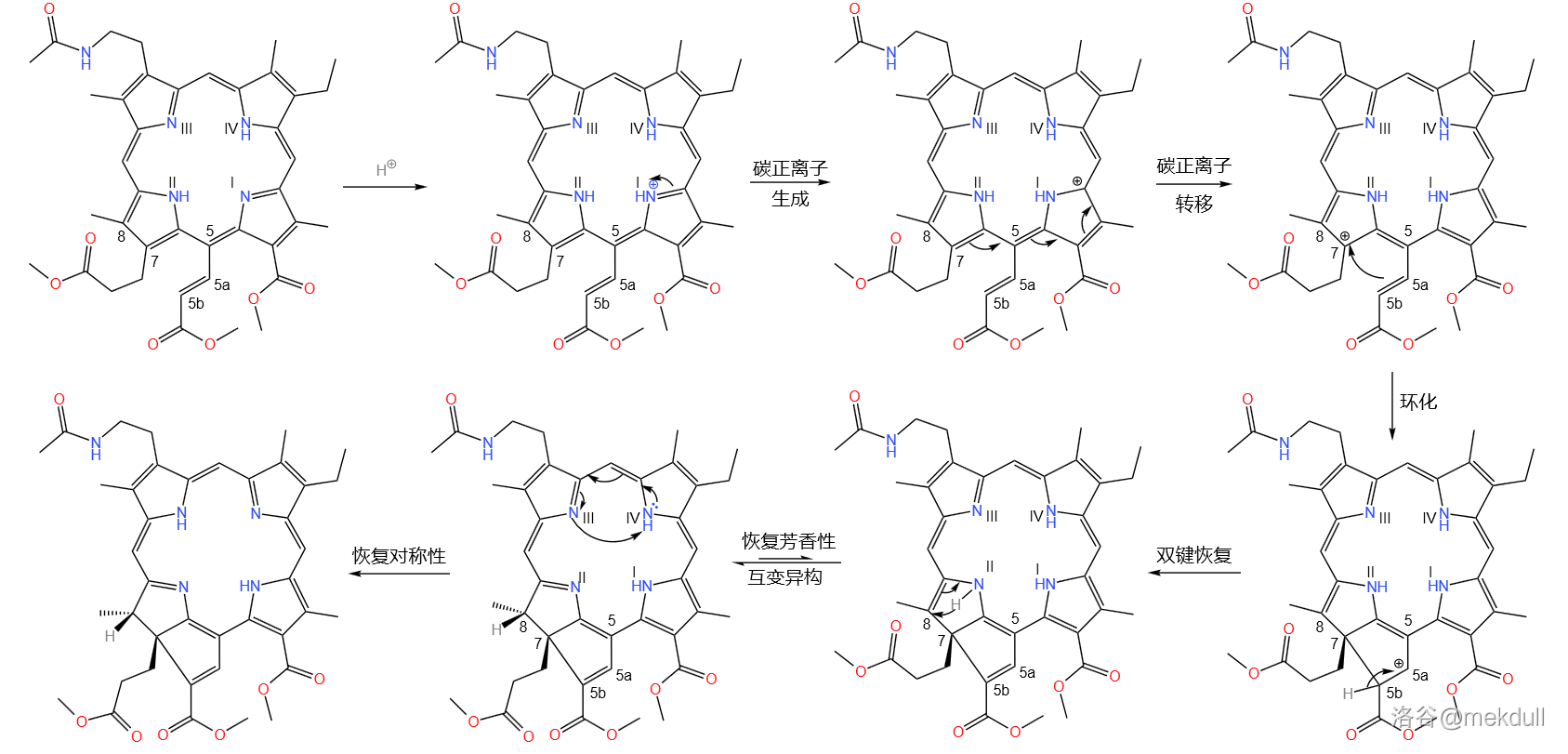
但这还没有完。在热的乙酸()的作用下,分子内部会发生可逆的重排反应。碳正离子经过多次转移来到 号碳原子上,随即 号碳原子上的双键进攻之,使得 号碳原子转变为 杂化;碳正离子转移到 号碳原子上,随即消去 号碳原子上的氢原子恢复双键;这样一来整个分子的芳香性被破坏,为了恢复芳香性, 号碳原子上的双键易位, 号氮原子上的氢原子转移,使得 号碳原子也转变为 杂化;最后,为了分子的对称性,上半部分的共轭体系自动调整, 号氮原子上的氢转移到 号氮原子上,完成整个反应历程。
这一步反应构建了卟啉环 号碳原子上的缺陷,具有良好的立体选择性,产率更是高达 。同时,它构建起了一个五元稠环,并完成了对整个卟啉环系的调整,整个反应浑然天成,巧妙至极,简直令人拍案叫绝:
随后,课题组用 脱去了氨基的保护,并用硫酸二甲酯()对其进行甲基化。接着便是在 中进行 消除,得到 号碳原子间的双键:
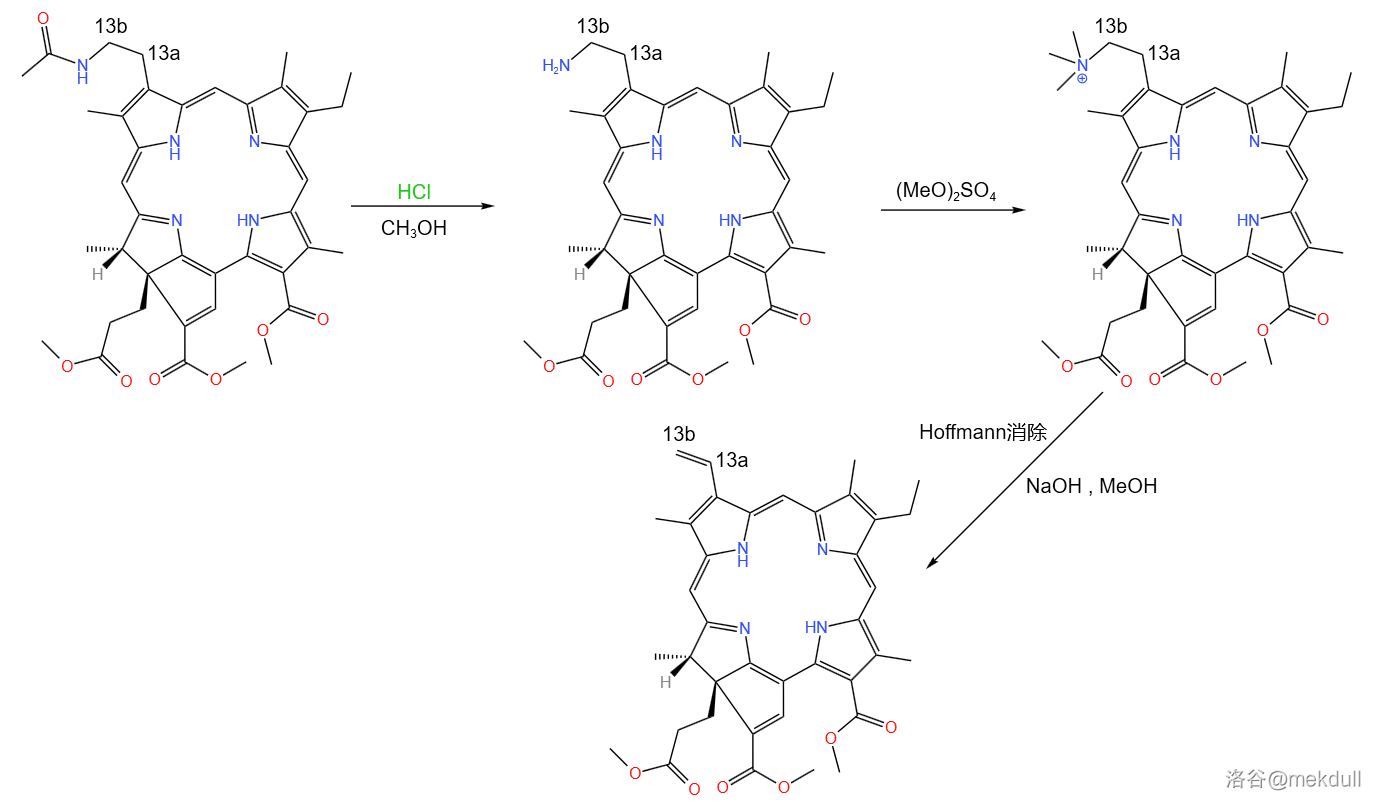
消除反应一般是以 或者是 机理进行的。在有多种方向时,这种消除通常是反 规则的,得到取代基少的烯烃。
接着,在强光下用氧气处理上反应的产物。在这种环境下,氧气首先变成单线态氧(),随后与 号碳原子上的双键发生 环加成反应。由于过氧键()不稳定,所以四元环会迅速开裂得到两个羰基:
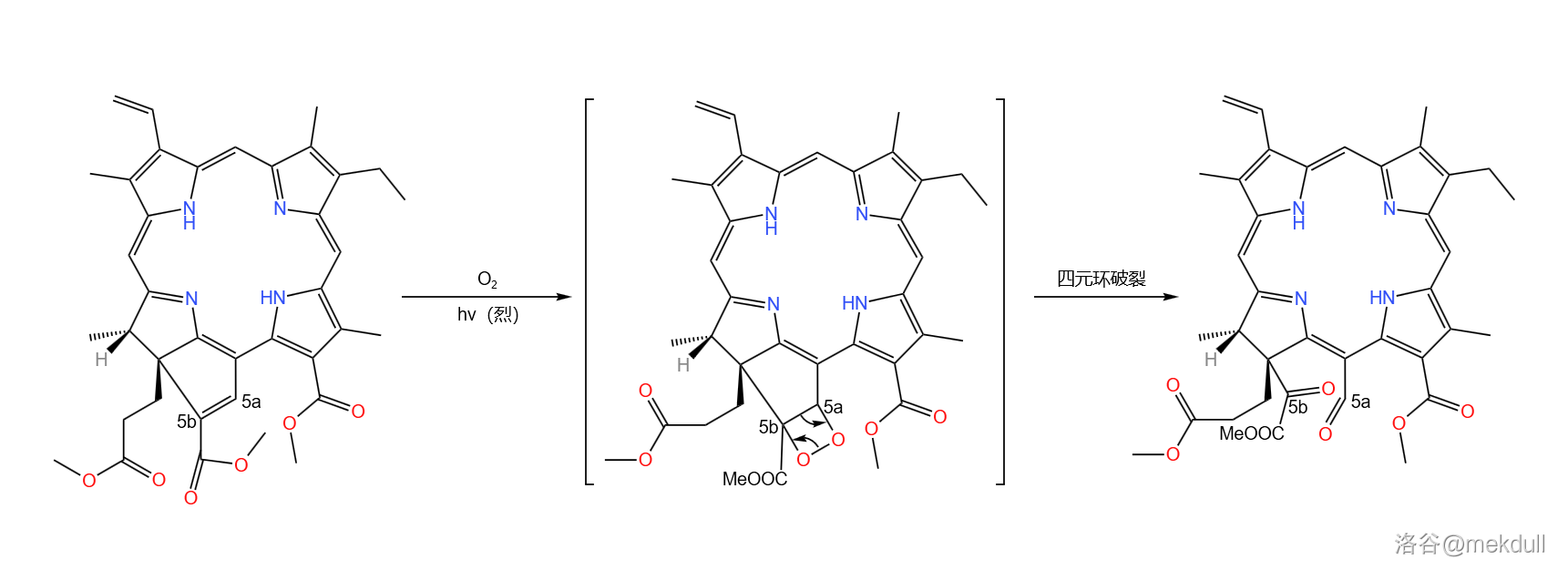
(注:单线态氧更多时候与双键发生烯反应(),但在这里不行,因为没有可以被褫夺的氢原子)
这样一来,空间位阻再次变得超大,同时 号碳原子上形成了 酮酸酯的结构。在稀的甲醇钾()作用下,酯基先被水解,得到的 酮酸随即发生脱羧与脱羰基反应,得到 号碳原子上的氢原子。但同时, 号碳原子上的酯基也被水解,随后与 号碳原子上的醛羰基缩合环化; 号碳原子上的酯基也被水解:
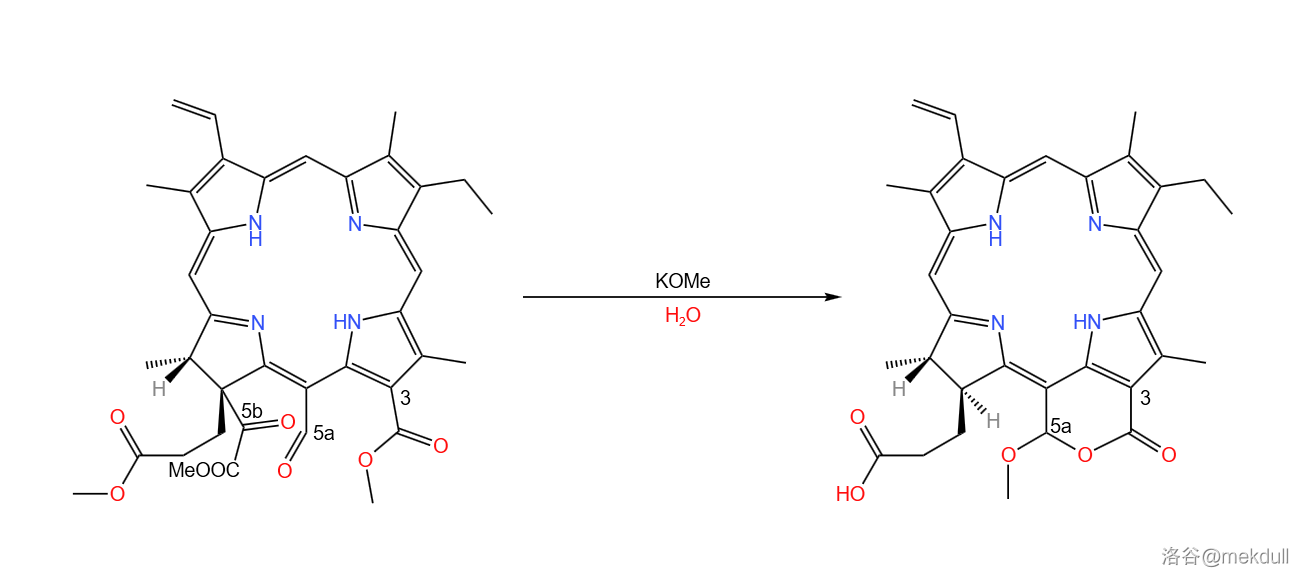
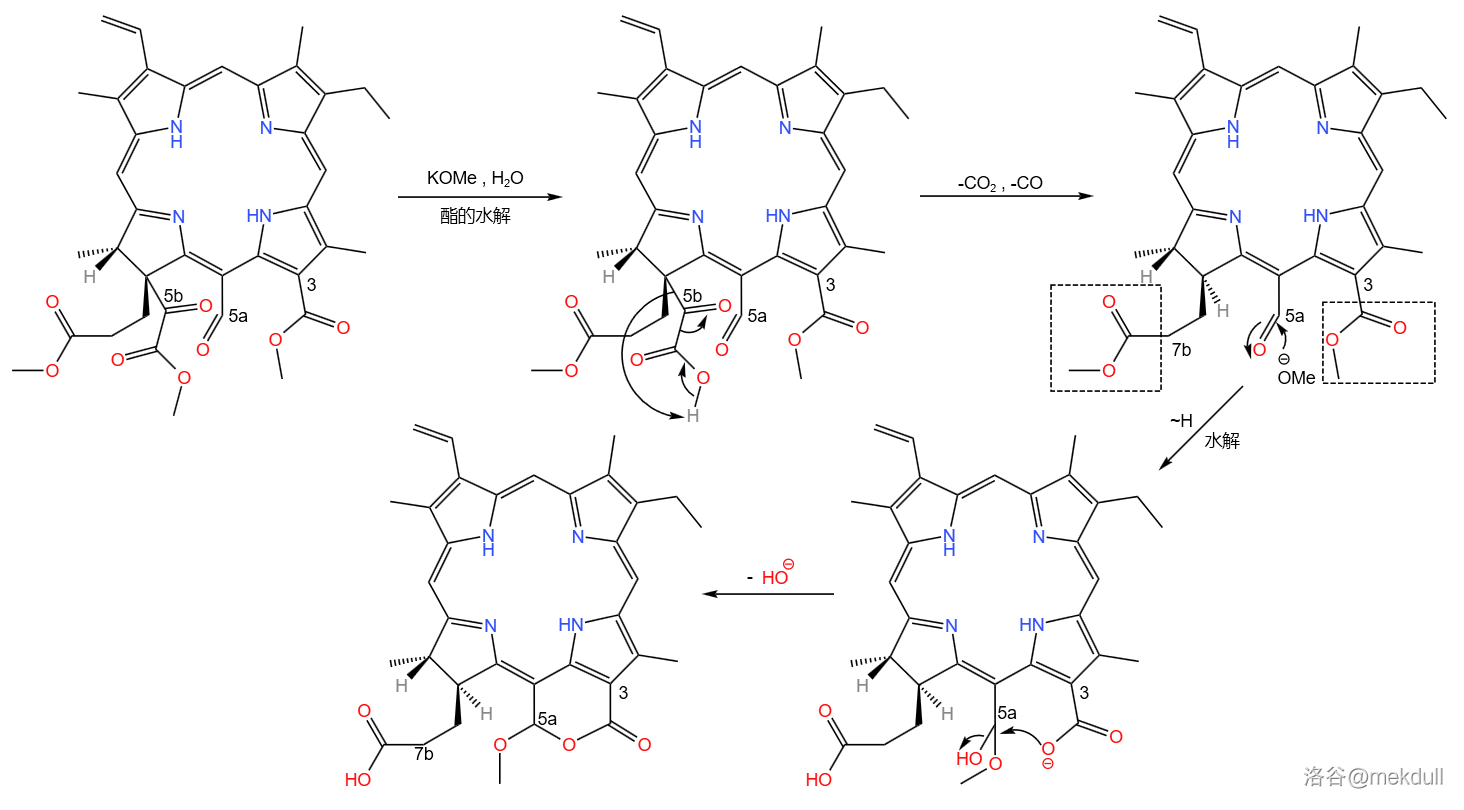
下一步,在二噁烷/水中, 号碳原子上的甲氧基()被很稀的 水解,得到羟基:
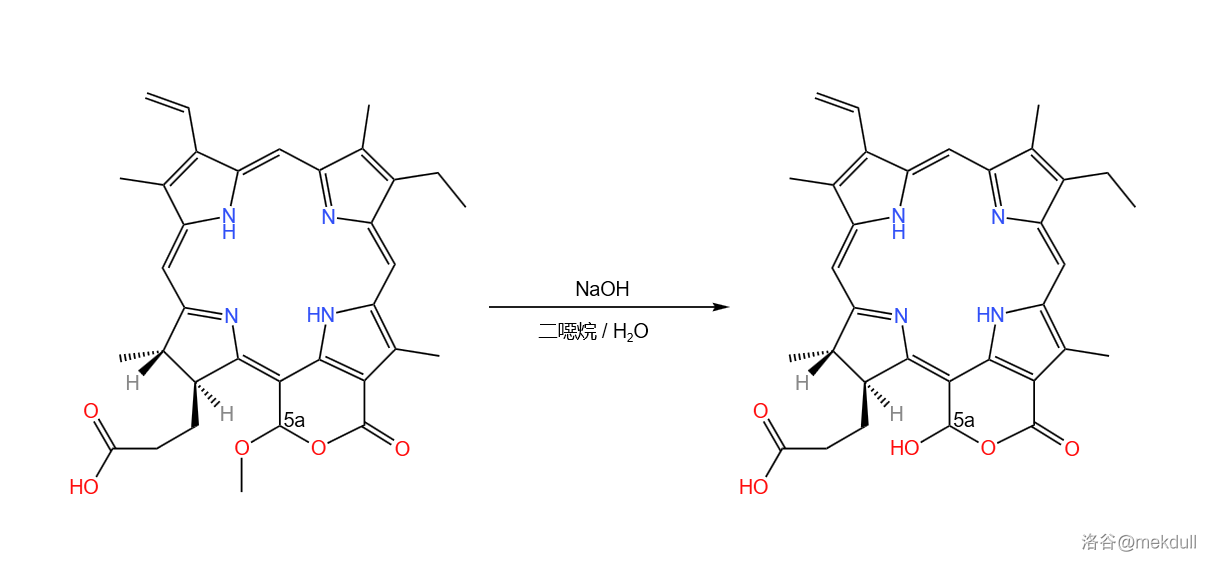
随后,该物质与重氮甲烷()进行反应。 号碳原子上的羧基被酯化,同时六元环破裂,恢复 号碳原子上的醛与 号碳原子上的甲酯结构:
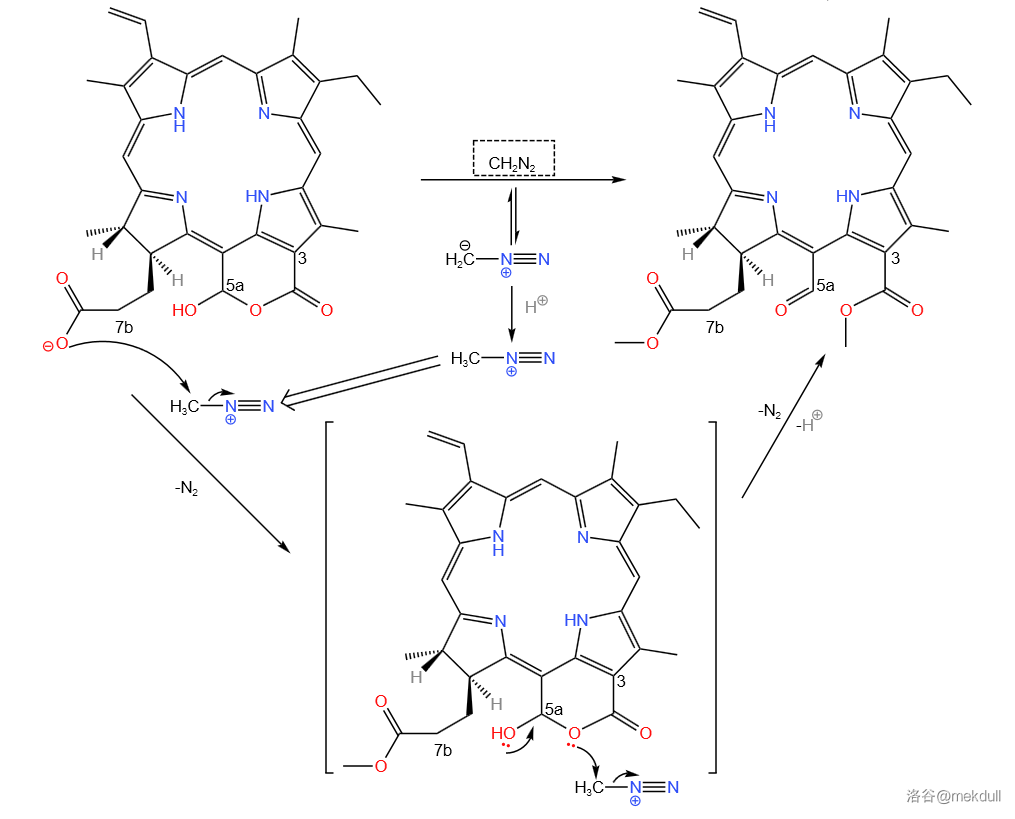
接着,在碱(三乙胺,)的作用下,该物质于 反应。 首先进攻 号碳原子上的醛羰基,生成氧负离子;随后氧负离子进攻附近的酯基成环:
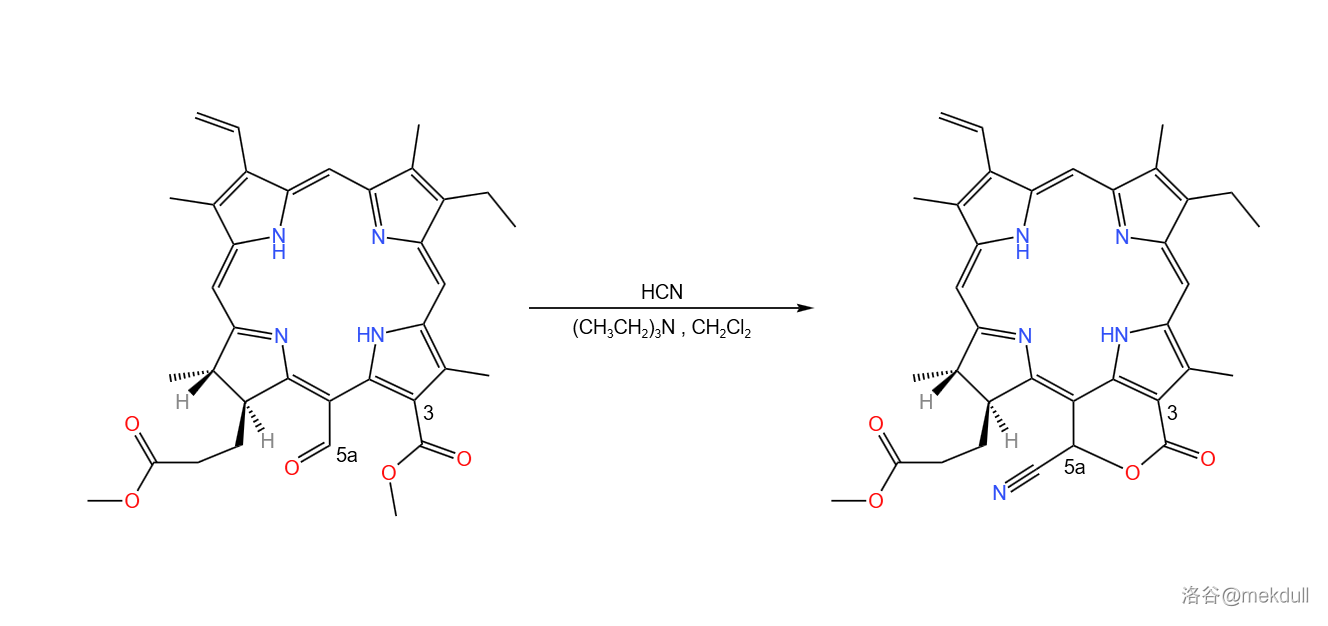
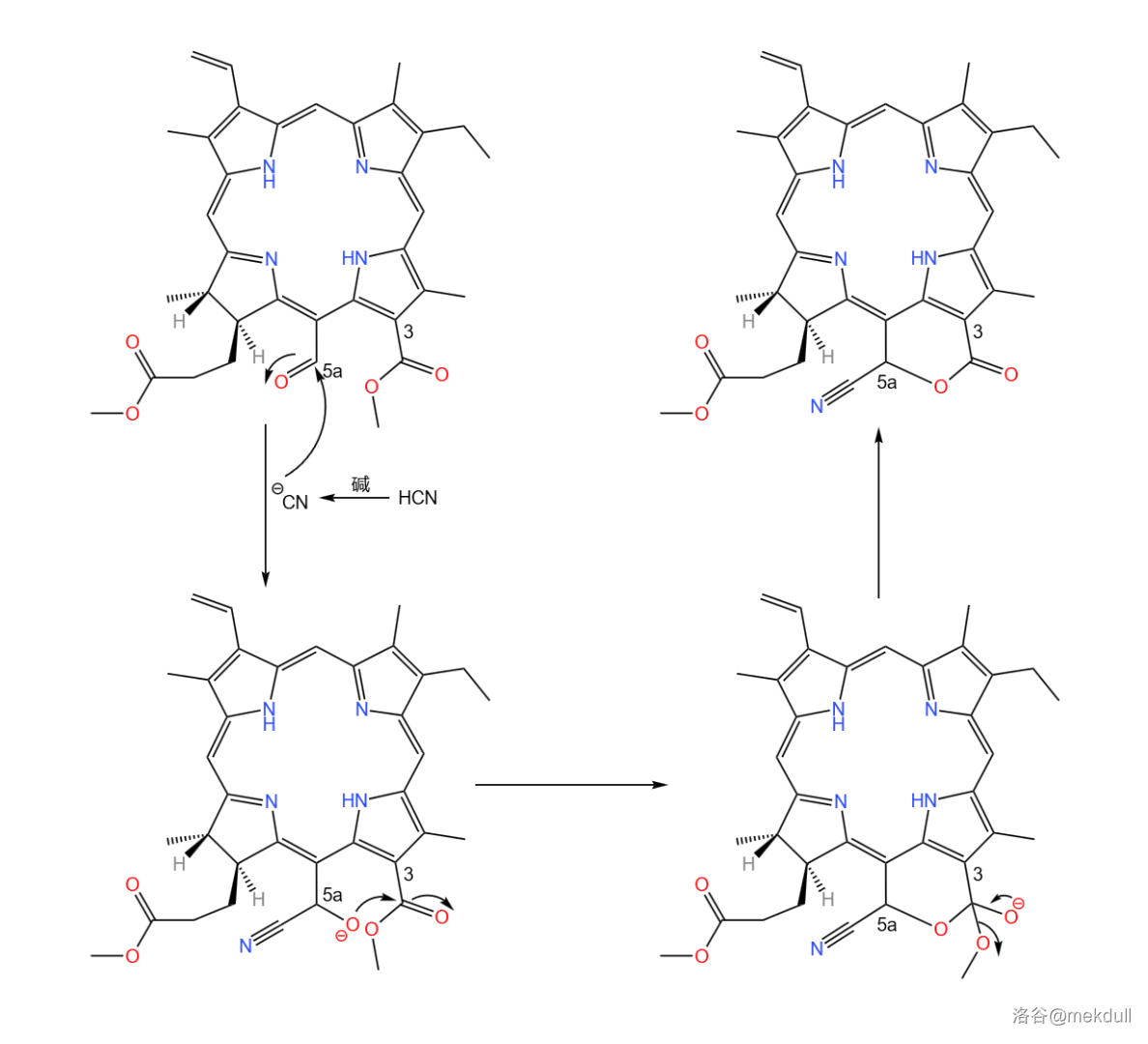
下面一步,使用有机化学中最传统的还原体系(之一)——(锌-乙酸)还原这一物质,打开其内酯环后得到 号位上的羧基,随后加入重氮甲烷酯化之:

随后,在 作用下,氰基()被水解为羧基;加入 后,得到 号碳原子上的甲酯;接着在 的作用下,分子内发生 缩合反应,完成叶绿素分子右下角五元环的构建:
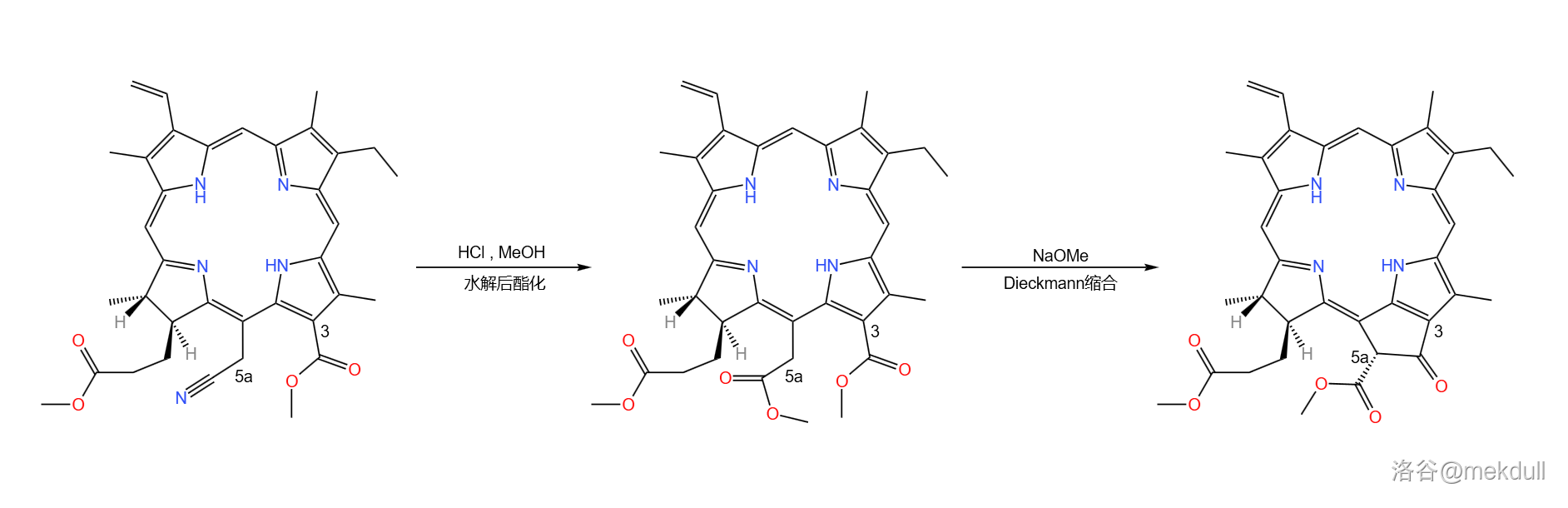
缩合实质上是分子内的 缩合反应,在天然产物的合成中应用很广。反应机理如下,碱先夺取一个酯基的 ,生成烯醇负离子;随后烯醇负离子进攻另一个酯基,烷氧基离去得到产物:

一般来说,对于不对称的底物, 缩合可能得到两种产物。但在我们的这个反应中,由于其中一个酯基没有 ,所以产物单一。
就这样,利用内酯环的形成与破裂,我们以一种极为巧妙的方法完成了对卟啉环的修饰。现在,离成功只差临门一脚了:拼接 号砌块,并把一个 离子配位到中间,赋予其翠绿的颜色。
3.3 6号砌块的拼接
最后一步其实很简单。我们得到的东西在 号碳原子上已经是一个酯的结构了,只不过这个酯是甲酯,现在要做的就是把它转换成另一个酯,即叶绿酯。这个酯对应的醇是叶绿醇,在概述中我们已经提到了这个醇的合成方法。那么,只需要使用经典的酯交换反应就可以了:
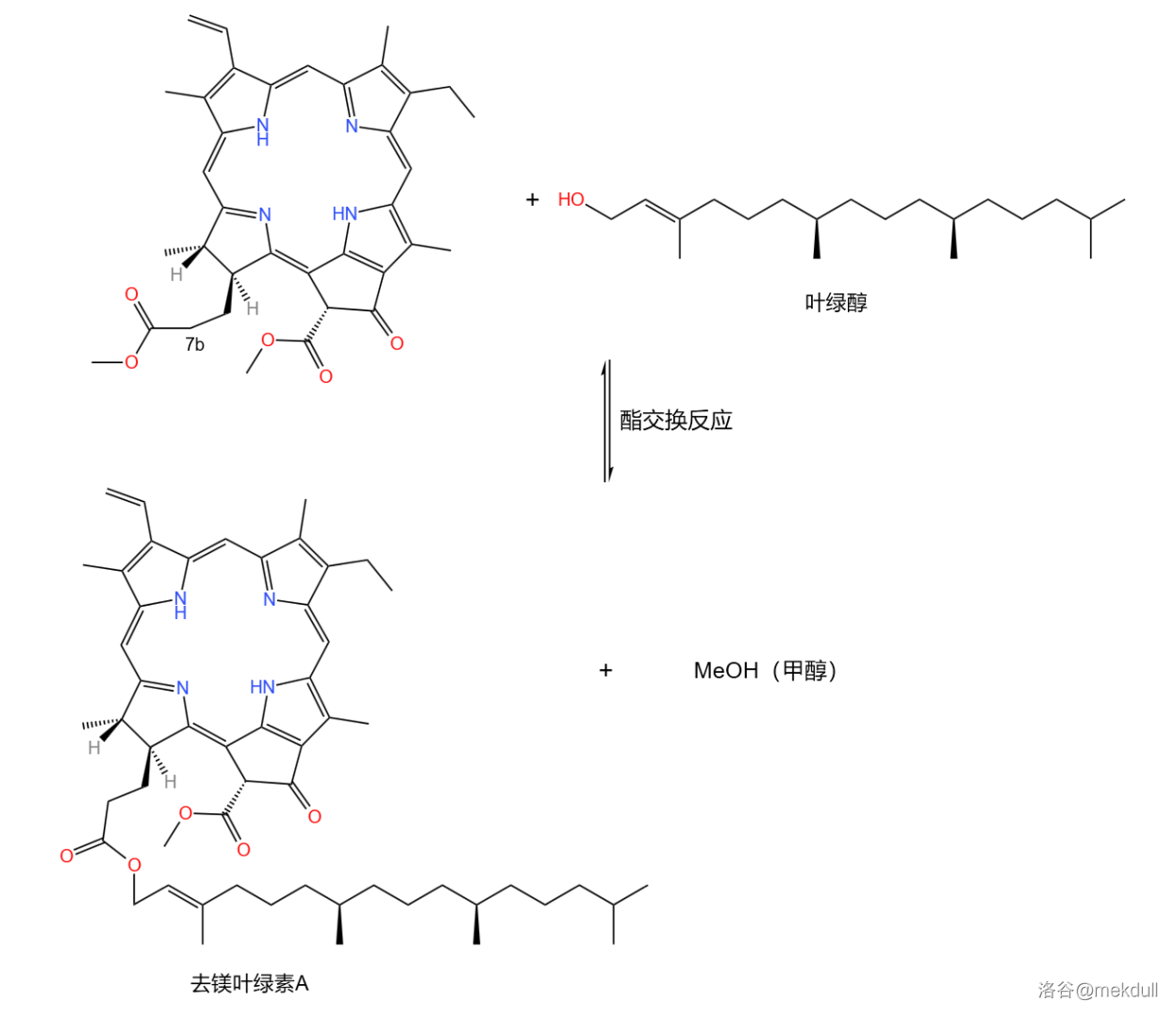
酯交换反应是一个可逆反应,但我们可以通过不断地把甲醇蒸出体系使得反应可以进行到底。
这一步结束后,我们就得到了去镁叶绿素A。最后一步,即将去镁叶绿素A与 反应,把中心配位的 离子加上去。需要注意的是,每一个 的加入都意味着 个 的离开,所以反应体系会逐渐变酸,需要及时加入碱中和或使用酸碱缓冲体系。
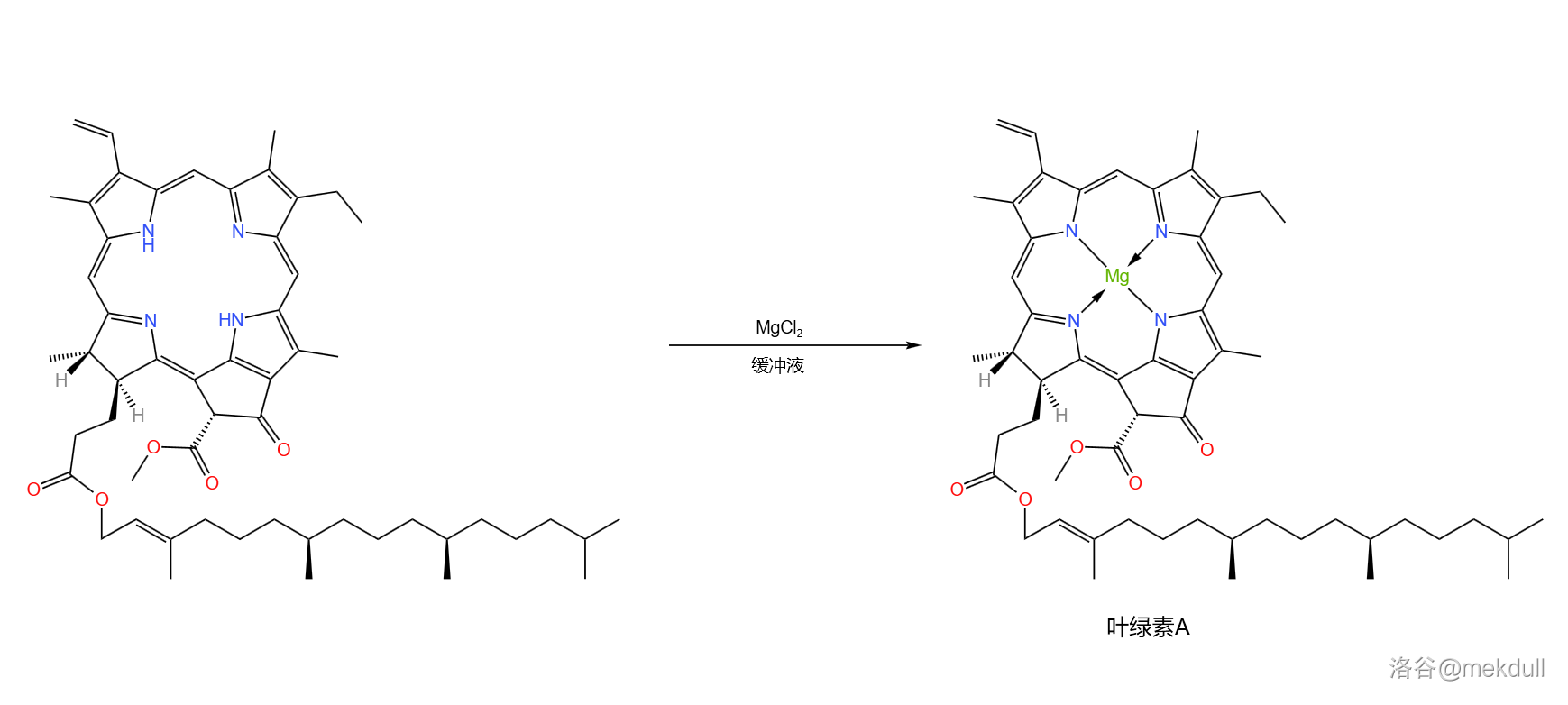
至此,那一抹亮丽的绿色终于呈现在了课题组的眼前。
4.总结与后记
叶绿素A的全合成是有机化学史上的一项壮举。在那个大多数人还不太相信人类可以合成这么复杂的物质的时代,这一工作向世人展示了有机化学的力量。虽然在一代代化学家的改进下,伍德沃德的合成路线早已不是合成叶绿素的最优解,但我们依然无法否认他的伟大。 年,他因为“在有机合成领域做出巨大贡献”而活动了诺贝尔奖。正如颁奖词中所说:他把合成做成了艺术。
然而,伍德沃德的时代还没有过去。在获奖的同一年,他与另一位伟大的化学家(同时也是诗人、哲学家、艺术家)霍夫曼()提出了分子轨道对称性守恒原理——这也是 世纪中期理论化学最重要的突破之一。
据传,在去领诺奖的路上,伍德沃德望着窗外的蓝天,在脑海中拼凑出了头孢霉素()的合成方法。于是,他硬生生的将获奖感言变成了制备头孢霉素的学术讲座,他说他已经为头孢霉素设计了切实可行的合成方法,颁奖后,很快就能将它做出来。当时很多人都以为他只是开个玩笑(虽然如果真的是玩笑,那未免有点大)而已。
然后,一年以后,他就真的做到了。

(上图:《头孢霉素C的全合成》论文影,,伍德沃德等 人)
有人曾经提问:天然产物全合成的意义究竟在哪里?我最喜欢的回答只有一句话:”Because it’s there.”(因为它就在那里)。这句话原本是珠峰的攀登者,乔治·马洛里()说的,但它用在这里同样非常合适。每次谈起叶绿素A的全合成,我就会有一种感觉:这种物质作为地球生态的基石,重要性不言而喻。但在这个生态系统中,却有一种生物,他们在享受叶绿素的庇佑的同时又能够理解这个物质,理解其结构、作用、原理,甚至还能够设计一条路线,从而用简单而普通的原料合成这种复杂的物质……这一切是多么奇妙。
所以,在文章的末尾,我还是想再次向伍德沃德致敬。这篇文章在 年 月 日完成,而 天之后的 年 月 日就是他逝世 周年的纪念日。在这个特殊的日子,让我们对他,以及所有为人类科学事业奋斗的人,献上最诚挚的敬意!
最后是一个预告:我想在这个暑假完成一篇非常长的文章,去详细介绍维生素B12的全合成(由伍德沃德等完成)或者是牛胰岛素的全合成(由中国化学家钮经义等完成)。如果想看还请多多支持,感谢!(虽然下一篇文章估计不讲全合成)





































