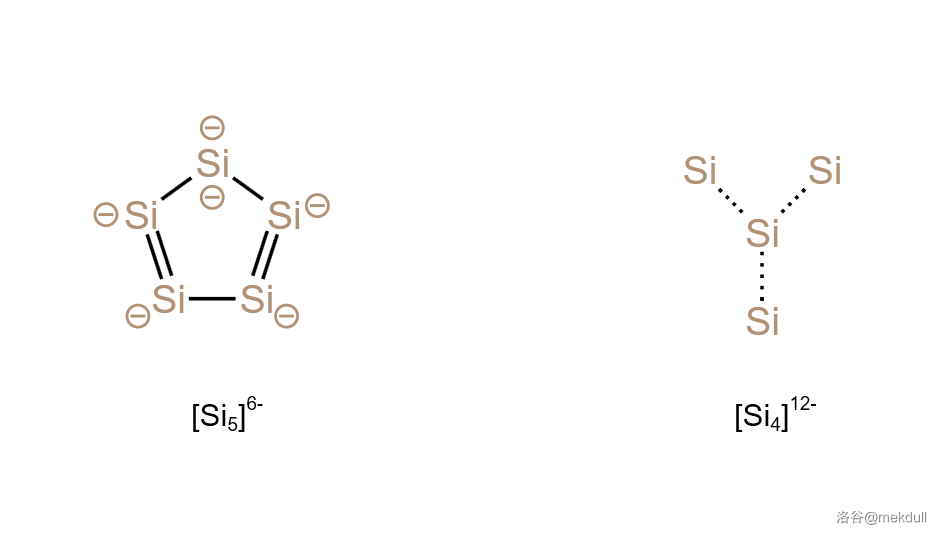引言
作为碳()在周期表中的同族元素, 号元素硅()一直吸引着人类这种充满好奇心的碳基生物的视线。作为地壳中含量第二高的元素,硅氧化物和硅酸盐体系凭借其极致的复杂多变和极端的稳定性,构建起了我们脚下的这片大地,也给今天的我们留下了无数的难题。

(上图: 元素在周期表中的位置)
(上图:一种沸石(属铝硅酸盐)的阴离子局部结构,图中每一条黄线都是 的链,部分 被 取代)
同样的事情发生在硅的氢化物——硅烷身上。由于碳氢化合物在有机化学中的地位,硅氢化合物自然也是研究的重点。早期化学家希望用有机化学的方法去合成和研究硅烷,可实践却证明这条路行不通。硅烷与碳烷的性质大相径庭,前者性质更接近于硼烷(毕竟有对角线法则在),而比后者不稳定的多。
面对这些不听话的东西,有些人强行给它们贴上了各种标签。一会儿说“硅原子自相结合成链能力差,无法形成复杂的氢化物”(很多教材都写硅烷的 值最大只能到 ),一会儿又说“硅原子半径大,无法形成 键”。这些论断,学化学的估计多少都听过。可事实真的如此吗?

(上图:由 等人合成的一个含有 键的稳定化合物,发表在 年的某期 上。在后续研究中,极不稳定的乙硅烯()的存在也被确认)
(上图:高级硅烷的代表之一 的结构与球棍模型(计算机渲染得到))
事实上,在 世纪的今天,早期化学家给硅烷贴的很多标签已经被新的研究扯下来了(虽然还是有很多教科书始终持传统观点)。但如此一来,我们却发现:一个更加扑朔迷离的世界呈现在了我们面前。
年,著名结构化学家 提出了“原子簇”()的概念,用以描述那些由多个同种原子直接键合形成的骨架结构的物质。自此之后,原子簇化学成为了无机化学最为活跃的领域之一。人们发现了很多奇形怪状的金属原子簇,但它们的中心原子却基本上都是过渡金属。后来,各种结构复杂的硼烷被人们发现(想具体了解的可以看这篇)。化学家们意识到,许多硼烷与金属原子簇有高度的相似性,于是便有了主族类金属原子簇的概念。
那么,很自然的,处于 元素对角线上的 元素,是不是也可以形成类似的化合物?答案是肯定的。但它们中的一些,又给我们带来了新的问题。比如,它们到底是如何成键的?为什么它们可以稳定存在?
(上图: 原子簇的结构)

(上图:八叔丁基硅立方烷()实物,一种美丽的紫色晶体。关于它的合成与结构在这篇文章中已有讨论。)
总之,在它们身上,还有太多的谜团等待着我们去解开。那么现在,就让我们一起去了解一下这些奇妙的物质。请记住,在欣赏或惊叹的同时,不要让那些偏见和标签束缚了你的思考与想象,毕竟我们要进入的不是经典理论的温柔乡,而是一片迷雾重重的险峻之地。
注:在这篇文章中,我会把碳氢化合物统称为“碳烷”,从而与硅氢化合物(“硅烷”)更好地进行对比。
正文
简单硅烷的性质与制备
硅单质一般不能与 直接作用,因此硅烷的制备只能采用间接法。最简单的方法是用金属硅化物与酸(或水)反应,但在硅化物的选择上也有些讲究。一般使用的是 与 或 直接反应得到的硅化镁()或硅化钠():

(上图:硅化镁与水反应生成的硅烷在空气中自燃)
需要注意的是,这个反应生成的物质其实极其复杂,主要是因为原料 (或 )的纯度几乎不可控,其中含有大量不同比例的 (或 ),因此会生成很多更高级的硅烷。
工业上用硅烷来生产高纯硅或者沉积薄膜时一般不会考虑纯度,但如果你想要的是纯度更高的甲硅烷(),那么下面这种方法将会是你的首选:
甲硅烷是最简单的硅烷,结构和甲烷一样,是经典的正四面体:
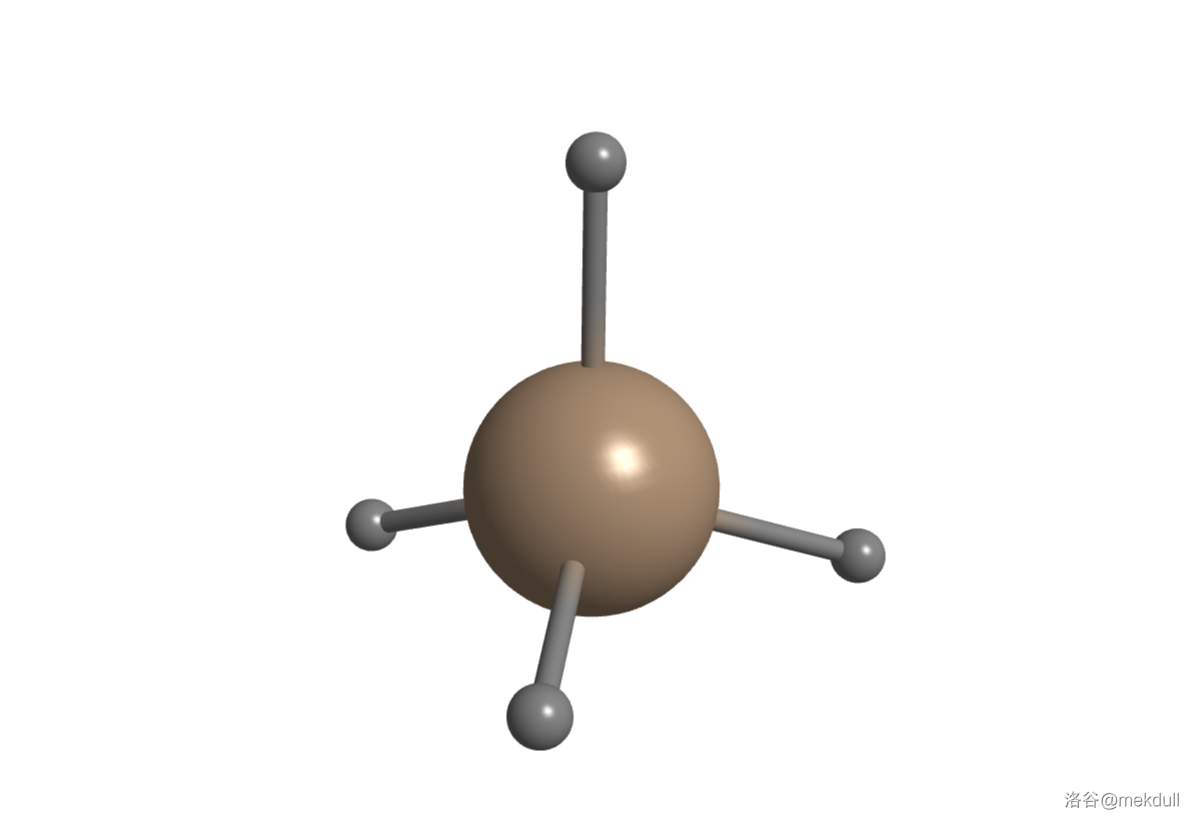
它在室温下无氧时是稳定的,但在空气中却是一种爆炸极限极宽()的危险气体。如果没有其他更不稳定的高级硅烷掺杂于其中的话,纯净的甲硅烷并不容易自燃,但如果去点的话肯定一点就着,放出大量的热:
甲硅烷在 左右分解为 和 。这个反应在半导体工业中非常重要,但篇幅所限,在此不做讨论。如果单看热分解温度的话,你会发现一件奇怪的事:甲硅烷的分解温度比旁边(理论上更稳定的)的 和 还要高:
| 物质 |
化学式 |
分解温度 |
生成焓 |
| 甲硅烷 |
|
|
|
| 膦 |
|
|
|
| 硫化氢 |
|
|
|
显然, 的分解涉及动力学因素。研究表明, 的热分解极其复杂(类似于硼烷),形成的各种高级硅烷中间体数不胜数,在后面讲到高级硅烷时我们会详细讨论。
甲硅烷在酸性条件下不水解,但只要有痕量的碱存在,就会立刻剧烈水解:
在有机溶剂中, 与钾()作用,可以得到一种无色的晶体甲硅烷基钾()。它的阴离子()是一种非常强的路易斯碱:
这种物质常见的晶体是 型的,但阴离子 的取向却不是固定的,如下图,(黄色)周围的 个白色球都是 原子可能的位置;放大看,这些可能的位置是 个正三角形的顶点。当然,由于键角的存在,氢原子之间不可能挨得太近,因此理论认为每个 周围的 原子只有 种可能的空间排布:
和 反应,可以得到乙硅烷()。其他常见的用于制取 的方法也陈列在下方:
乙硅烷比甲硅烷更不稳定,不仅容易自燃,室温下还会分解(虽然速度极慢)。利用类似的方法可以得到丙硅烷()和丁硅烷()。和碳烷类似的是,丁硅烷也有两种异构体,分别称为正丁硅烷和异丁硅烷:
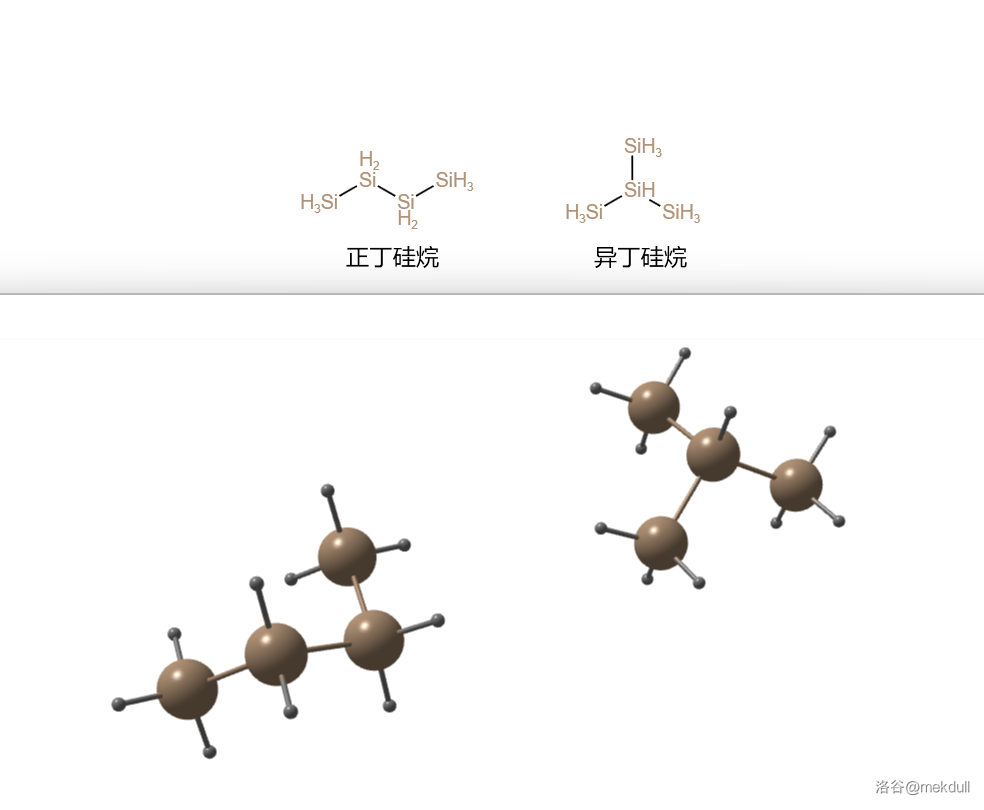
关于它们的部分性质列表如下,变化的规律与碳烷是类似的:
| 物质 |
化学式 |
沸点(K) |
密度() |
常温下热分解 |
| 甲硅烷 |
|
|
|
稳定 |
| 乙硅烷 |
|
|
|
分解极慢 |
| 丙硅烷 |
|
|
|
缓慢分解 |
| 正丁硅烷 |
|
|
|
分解较快 |
| 异丁硅烷 |
|
|
(数据缺失) |
分解较快 |
看到这里,你或许并不觉得硅烷有多么复杂,它们的结构也只是碳烷的翻版罢了。但请先别急,硅烷中真正的高手其实还未登场。
环硅烷及其衍生物
或许很多人都认为硅烷是不可以或者很难形成环状结构的,毕竟这种传统的观点说明了碳硅两元素氢化物的区别。但实际上,环硅烷()这个概念已经提出了有一百多年了。 年, 等人首次合成了环硅烷衍生物,并被鉴定为 (八苯基环丁硅烷)。合成路线如下:
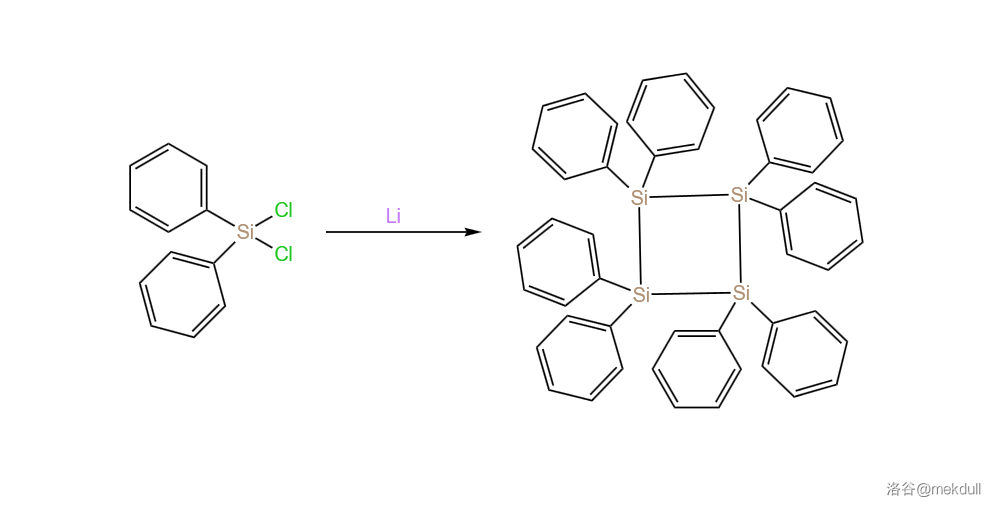
但一直要到几十年后,才有人开始关注这项研究,并从这个反应的产物中又分离出了十苯基环戊硅烷()和十二苯基环己硅烷()两种物质。 年, 等人在 催化下用 氯化 ,得到了 (中文一般称其为全氯环己硅烷)。随后,用强还原剂 处理之,首次制得了环己硅烷:
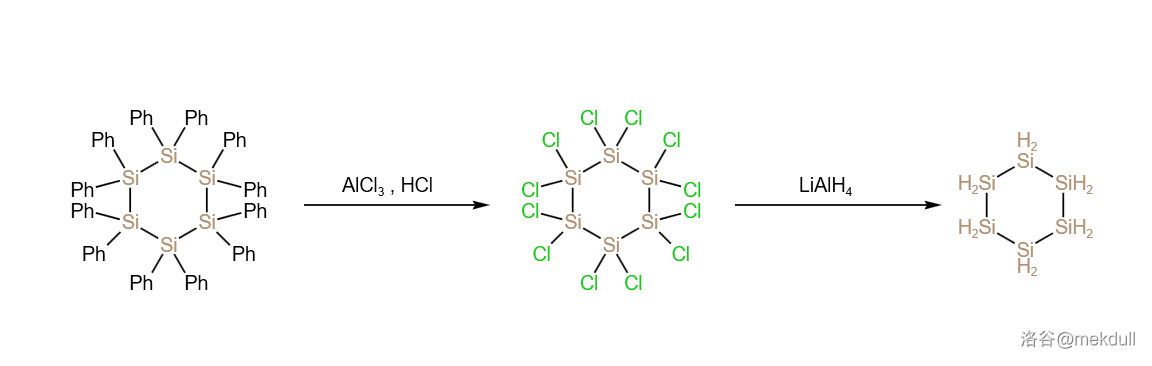
由于产率实在是太过于感人,所以在一代代化学家的改进下,我们已经有了更好的方法,具体过程如下:
注: 是五甲基二乙烯三胺()的缩写,它是一个很好的多齿配体。
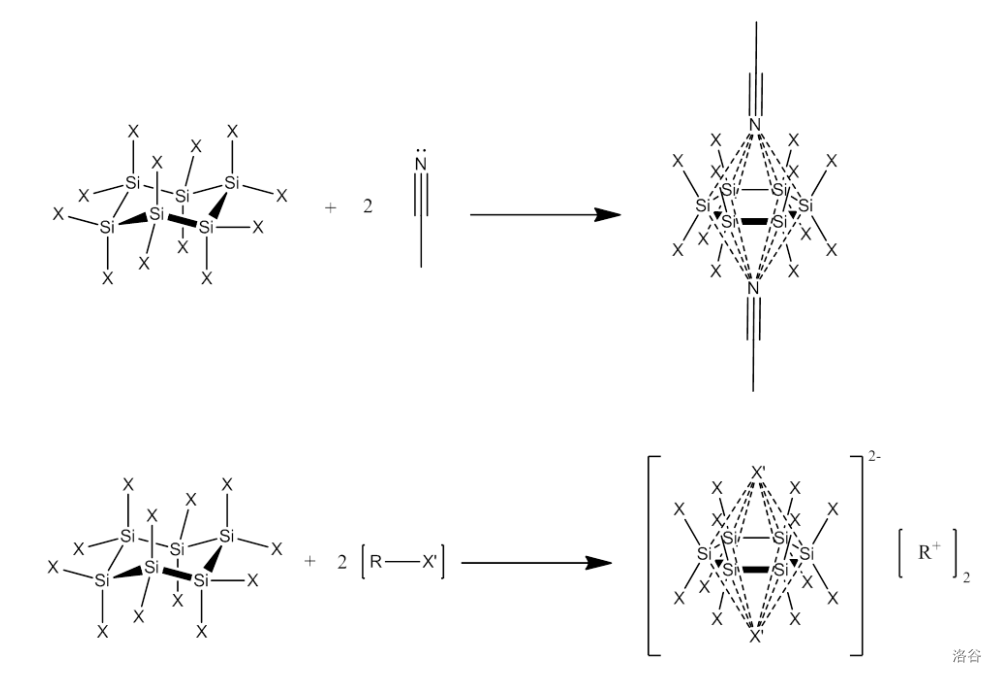
反应过程中涉及到一个有趣的阴离子:。在 被合成之后,化学家们就注意到了它的路易斯酸性,而这是结构类似的碳化合物不具备的。后续实验证明,多出来的两个 (也可以是其他路易斯碱)一个在环的上方,另一个在下方,形成如下的结构:
可以看到, 的 六元环几乎被“压”到了同一平面内,形成了一种独特的“反三明治型配合物”。
一般认为,它们之间的键是由碱的孤对电子与 个硅原子的 空轨道形成的。这个键高度离域,键能也不小,足以维系整体的稳定。不过,当 碰上比 更强的路易斯酸后, 依然会被抢走,发生类似于所谓强酸制弱酸的反应:
后续实验证明,五元环的 也可以形成类似的 。同样,五元环的环戊硅烷的制备与环己硅烷也是类似的,也是先用 氯化 ,得到 之后再用 还原:
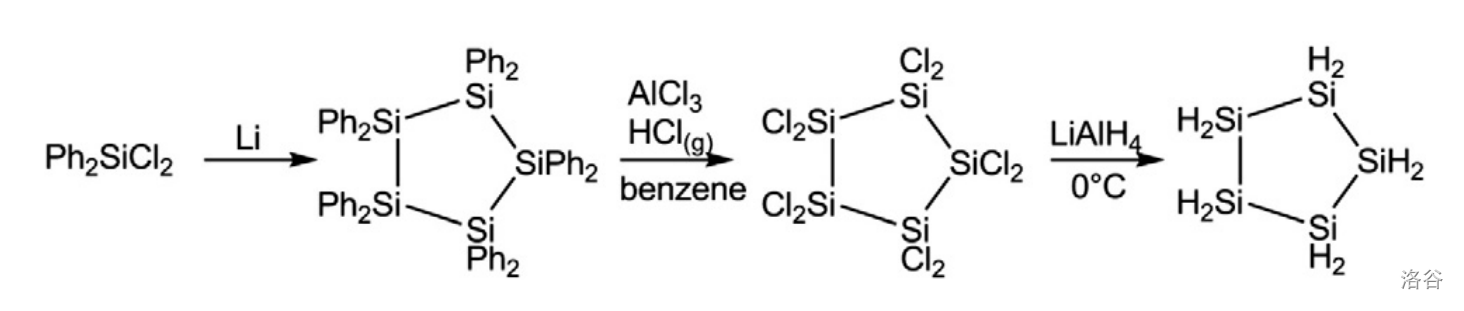
相比于其他硅烷,环硅烷最大的特点莫过于稳定——这与对应的碳烷是有相似之处的。以环戊硅烷为例,它在常温下是稳定的液体,如果不去点它就不会烧起来。在 左右环戊硅烷开始分解,生成一大堆乱七八糟的产物;在 左右完全分解。
年,化学家针对 的晶体结构进行了一系列实验,发现这种物质之中似乎存在一种诡异的分子间作用力。如下图,在每个 五元环的上下都存在一个氢原子,这个氢原子与构成这个五元环的 原子之间的距离明显小于它们的范德华半径之和:
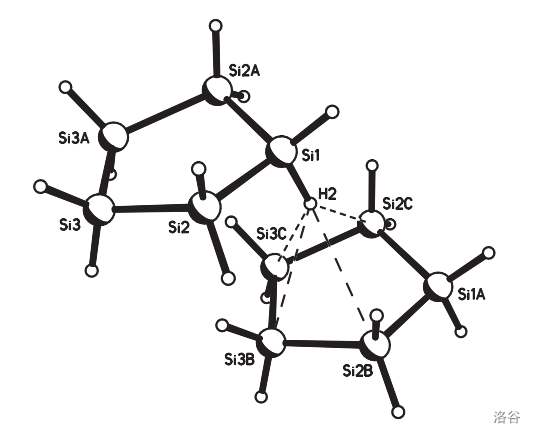
联想到 的结构,有人提出了一种解释。简单来说,由于 的电负性小于 ,这会导致共用电子对偏向 ,即氢在这个化合物中呈负电性。于是,这个负电性的氢就会与另一个分子中 原子的 空轨道作用,形成这种奇特的分子间作用力。
不过,问题还是没有解决。进一步研究表明,两个邻近的 分子中的两个挨在一起的 原子(比如上图中的 和 )之间的距离也小于它们的共价半径之和!这说明, 原子之间也存在一种尚不明了的分子间作用力。
事实上,环硅烷能够玩出的把戏远不止这么点。把刚才制取 的反应物换成六氯乙硅烷(),我们就可以一堆乱七八糟的产物,其中就有支链化的 六元环产物 ,结构如下:
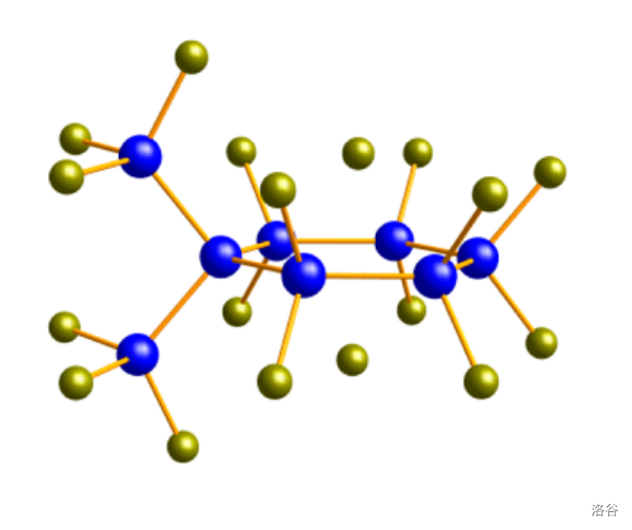
(上图:蓝色为 ,黄色为 ,可以看到两个 支链和六元环上下配位的两个 )
将其与 反应, 同样会被夺走,但产物 并不稳定,会逐渐开始聚合。反应至少 天之后可以以 的产率得到一种晶体 ,结构如下:
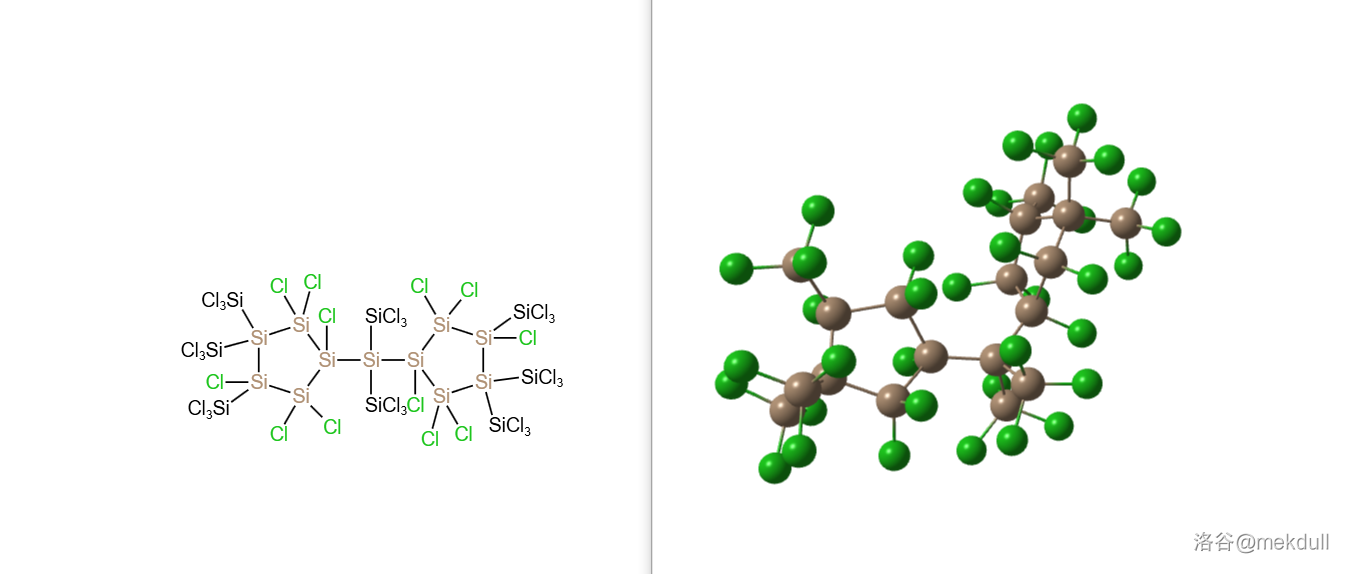
(注:反应的推动力应该来自于 几乎不溶于 )
最新的对该反应机理的研究表明, 六元环似乎可以通过某种方式发生“缩环反应”,变成支链化的 五元环,且 五元环有通过 桥相互交联的趋势。 五元环似乎要比 六元环更加稳定。
无论怎样,“成环”这个线索为高级硅烷的探究带来了一缕曙光。在之前关于硼烷的文章(Link)中,我提到过在化合物中最长的确认的 链长度也只有 ,但那只是对于链状硅烷及其衍生物而言的,而如果引入“环”,我们便能得到分子量更大、结构更复杂的硅烷。
高级硅烷与富勒硅烷
坦率来说,我们至今也没有很好的方法得到高级硅烷。前面提到过,甲硅烷()的热分解最终产物是 和 ,但过程中会产生巨量的高级硅烷中间体。于是,我们就可以用一定的方法鉴定它们。
在这其中比较有代表性的是 ,它的结构如下,像一个缺角的金刚烷。其中,有两个硅原子之间的键明显短于其他的硅硅键,结合这两个硅原子都只与附近 个原子相连,我们可以认为这个键是硅硅双键():
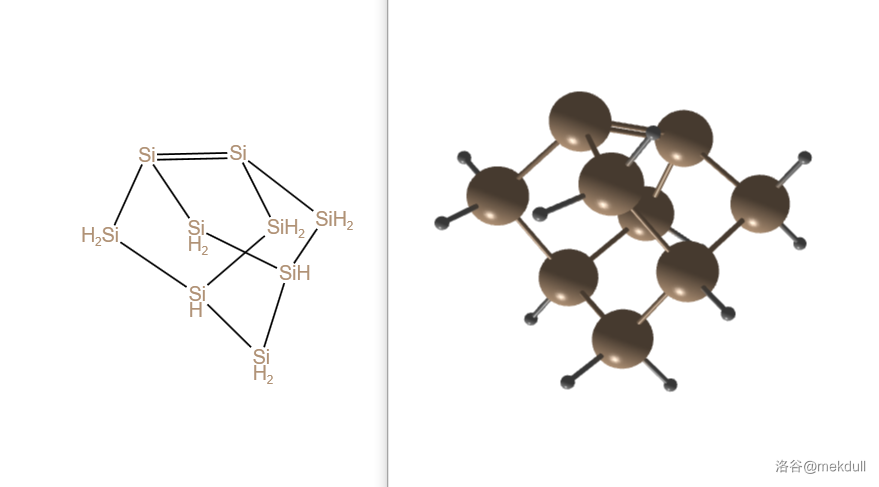
(注:由于双键的存在, 以及下面的 等物质严格来说应被归入硅烯家族而非硅烷。这里一并当做高级硅烷介绍。)
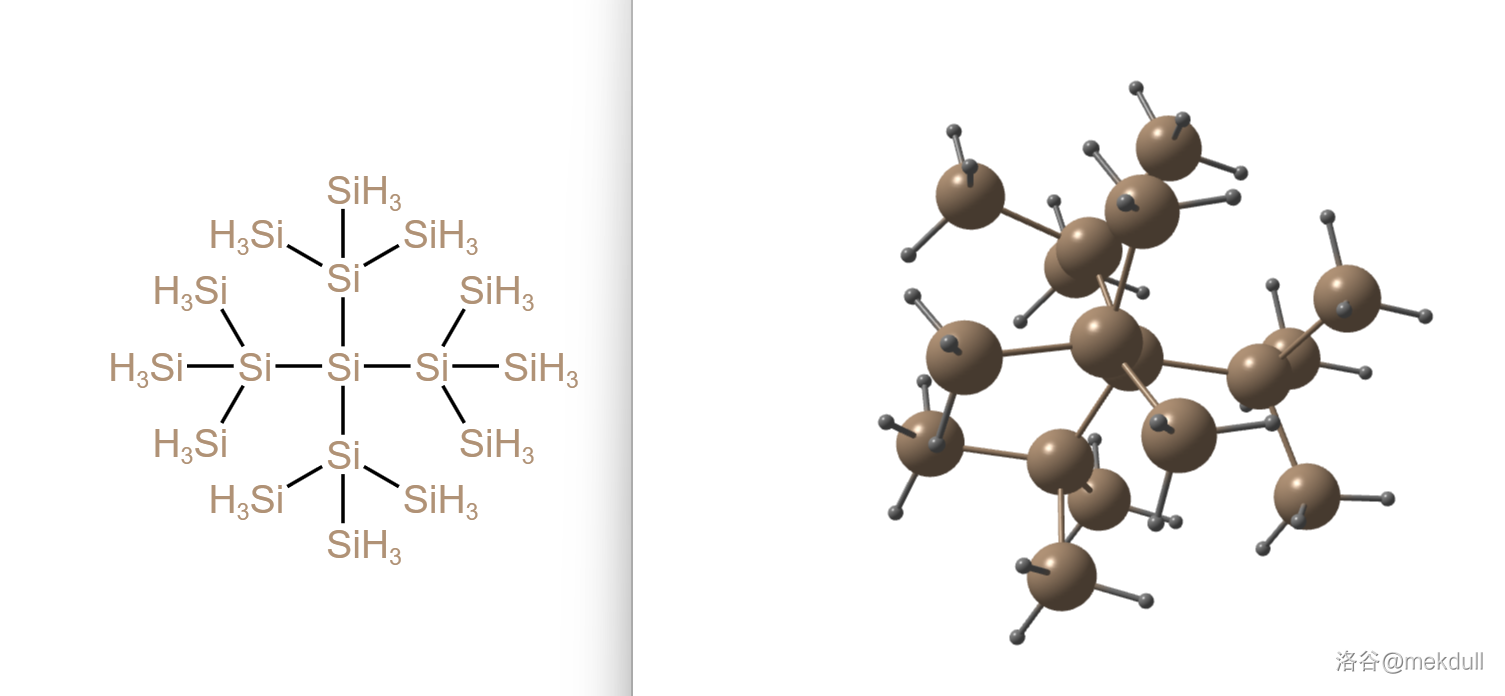
再多一个硅原子的 ,或者叫金刚硅烷也被研究得比较多。它的结构就是金刚烷()的翻版,且目前进行的理论计算都认为这是 能量最低的结构:
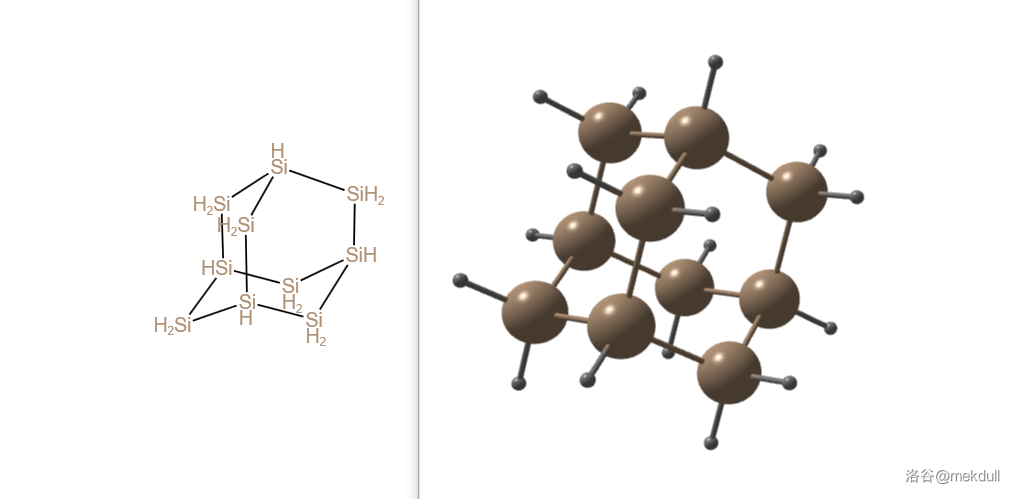
再往后就是一些比较大的东西了。比如多重金刚烷结构的 ,以及由 结构延伸得到的,同样有一个 键的 :
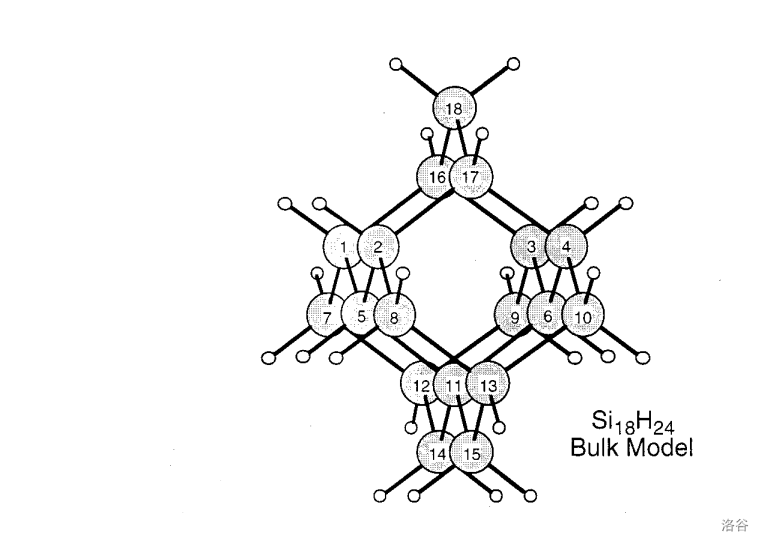
(上图: 的结构)
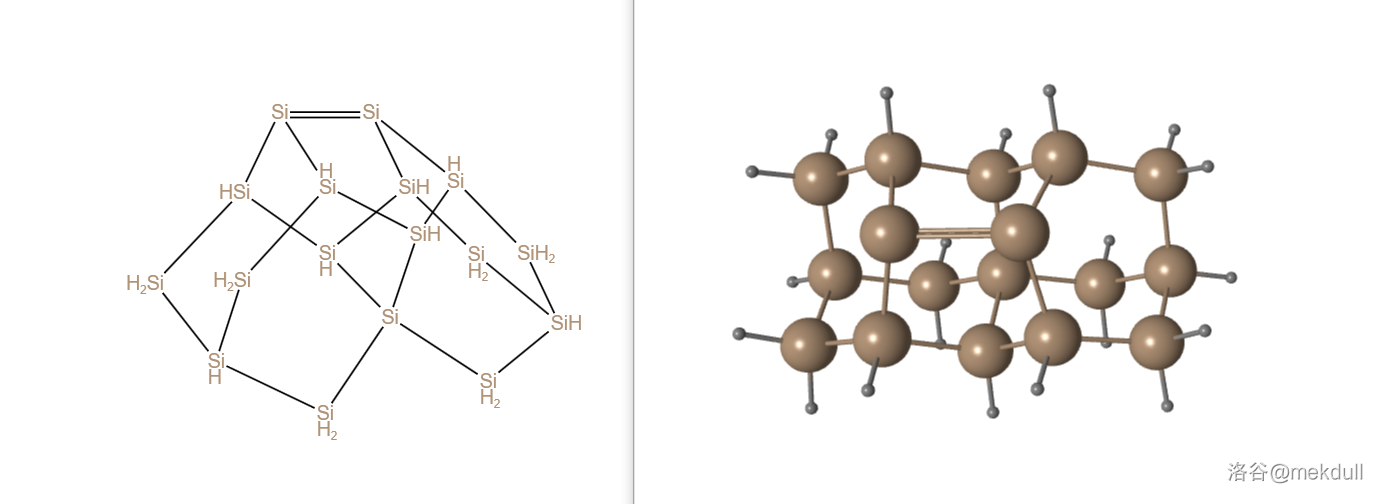
(上图: 的结构)
当然,我们也有一些庞然大物,比如下面这个 。有趣的是,它同样含有一个 的核心,即下图中编号为 的硅原子:
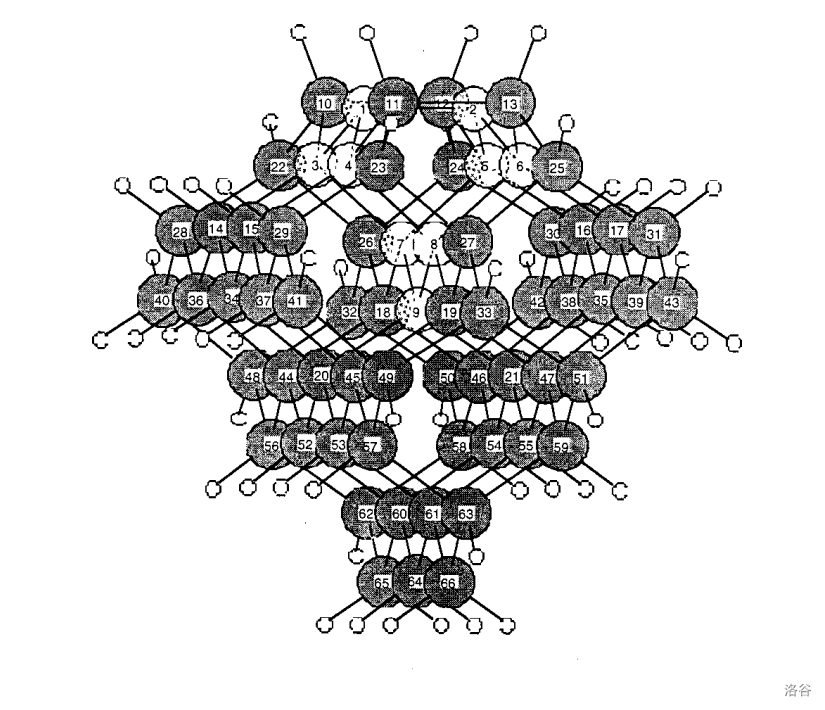
除了上面这些东西以外,这个家族还有一位重量级人物:聚硅烷()。在 下用 处理 ,可以得到层状聚硅烷(,):
需要注意,这里的“”意在表示它的结构,而不是说它是由 聚合而成的。如下图,它的结构与石墨烷(在我的这篇文章中有讲)类似,你可以把它想象成是完全加氢后的石墨的硅基版本:
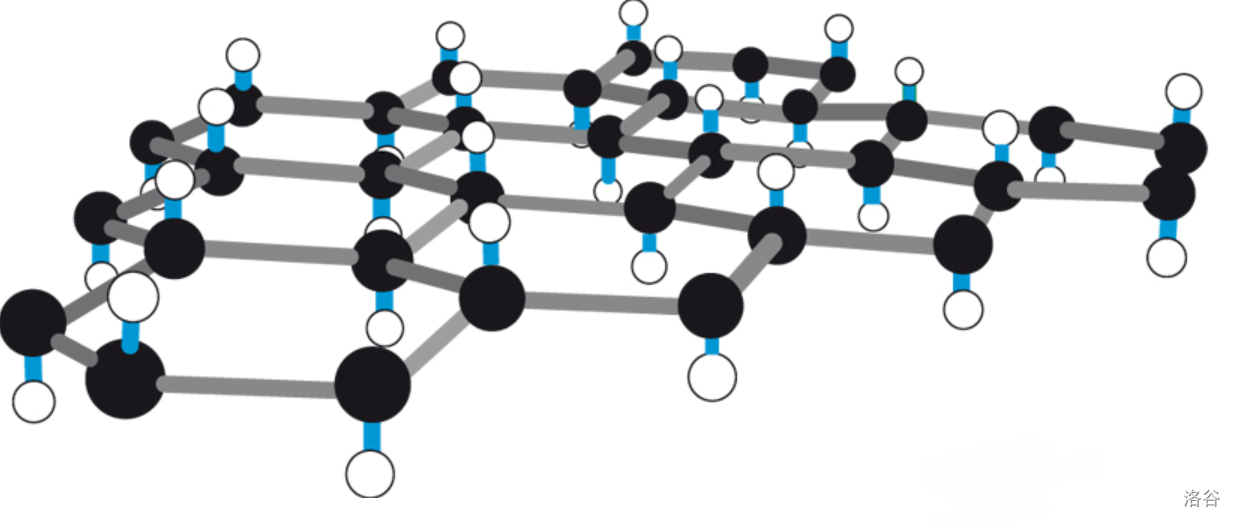
(上图:单层层状聚硅烷的部分结构,其中黑色:,白色:)
总的来说,和高级硼烷(见这篇文章)相比,高级硅烷的结构规矩多了。它们基本都遵守硅四价规则,也可以被简单的共价键理论描述。当然,也并不是所有硅烷都这么守规矩。
年, 等人合成了第一个富勒硅烷(即完全氢化的富勒烯的硅烷版本,)的衍生物离子 。它们发现,其中有一个 被包进了正十二面体的 笼之中,且正好位于正中心,与周围 个 原子等距。如下图:
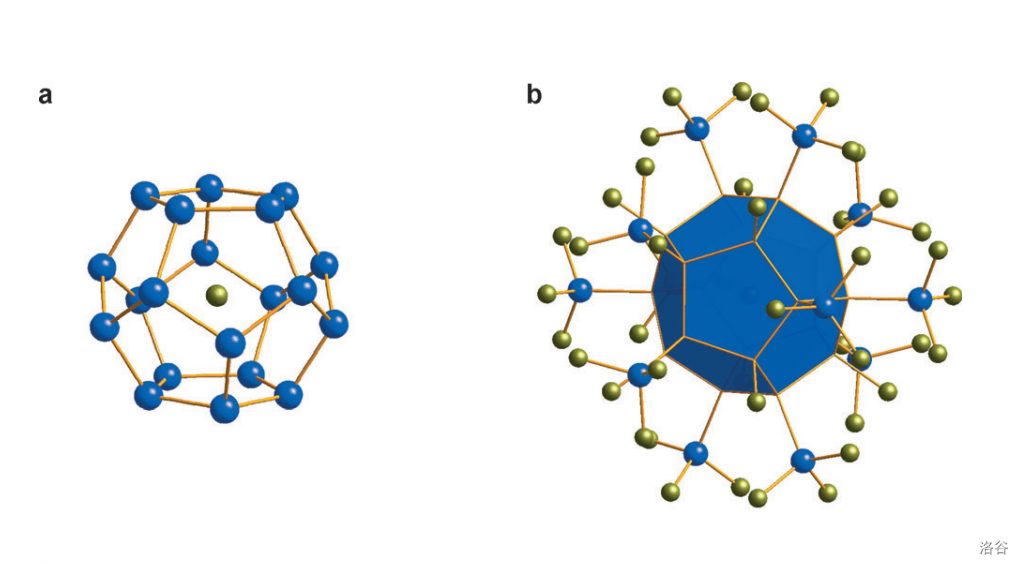
(注::分子中的正十二面体 笼核心和中央的 ;: 的整体结构。图中蓝球:,黄球:)
合成方法如下,当原料 时可以获得 的产率:
到了 年, 等人合成了真正的正十二面体硅烷(,)。但是, 笼中还是包着一个 ,所以它的化学式其实应该写成 ,或者更准确一点,。结构如下:
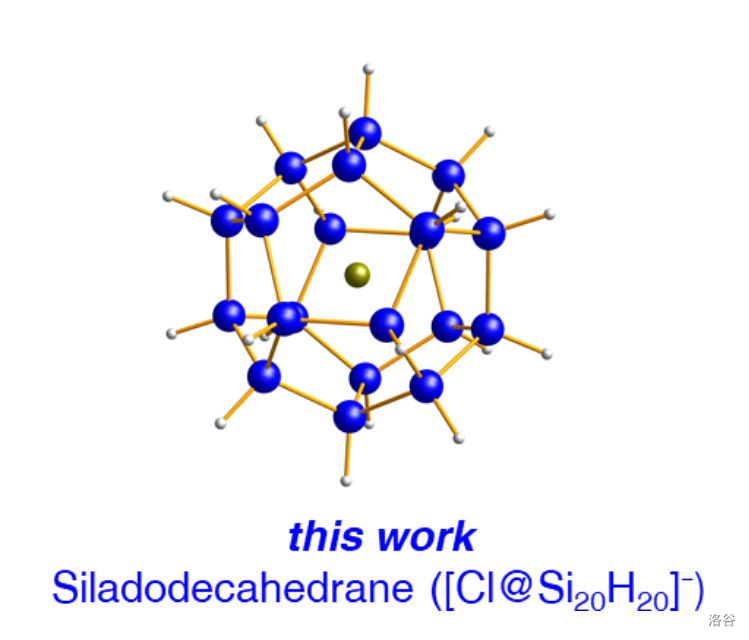
它的合成由 开始,共需要两步:
(注: 指频哪醇)
为什么在正十二面体 笼中会有一个 呢? 年, 等人的理论研究指出: 与构成这个笼子的 个硅原子之间存在一个高度离域的化学键,而这个化学键又与上面说过的 、 中的那个离域键(记不得的往上翻翻)非常相似。
基于这个发现和一些计算,他们提出了一个大胆的想法: 其实是构筑这个笼子的模板。即,并不是 原子形成笼子的时候正好把 关了进去,而是 原子在 表面自组装成了一个十二面体笼!
上文中提到, 形成的六元环或者五元环的上(下)方可以配上一个 。如下图,中心的 在与第一个五元环配位之后,附近的 原子便自动跑过来形成五元环与 配位,最终形成一个正十二面体笼(正十二面体的每个面都是 五元环)。而由于配位的位置要求, 必须要在所有五边形的正上(下)方——也就是正十二面体的中心:
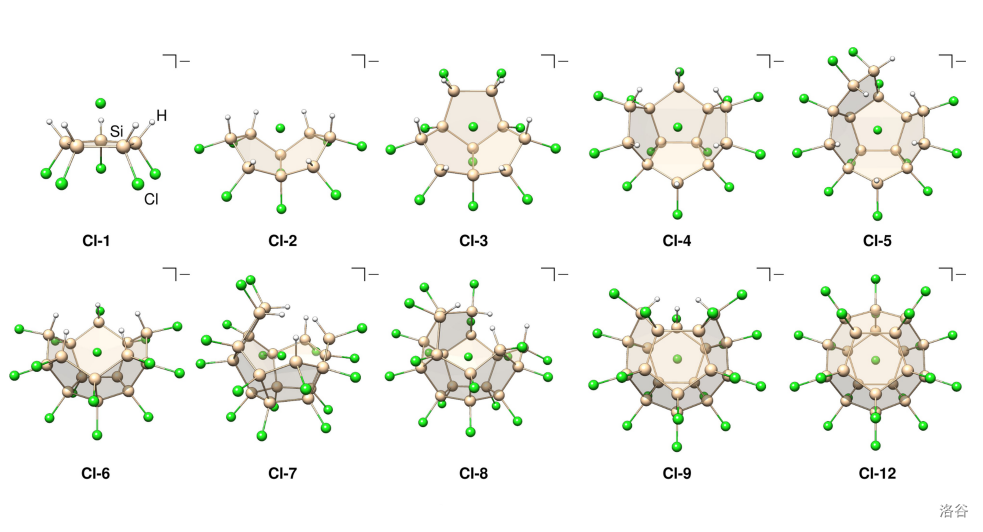
(上图:硅原子在 表面自组装成正十二面体的过程示意)
总之,这些物种刷新了人们对于硅烷的认知。化学家们也逐渐意识到,碳烷和硅烷终究不能一概而论,虽然两者的结构确实很相似,但一味套用有机化学的研究和合成方法只会限制这一领域的发展。因此,近些年来,一个新的名词被越来越广泛地用来描述这类物质:硅原子簇。
事实上,硅原子簇是一个比较广义的概念,包括了所有由 原子直接键连形成环状或笼状骨架的化合物。我们上面所说的高级硅烷、环硅烷和它们的衍生物全被包括在内。当然,除了它们之外,还有一类硅原子簇也不得不提:硅负离子原子簇。
硅负离子原子簇
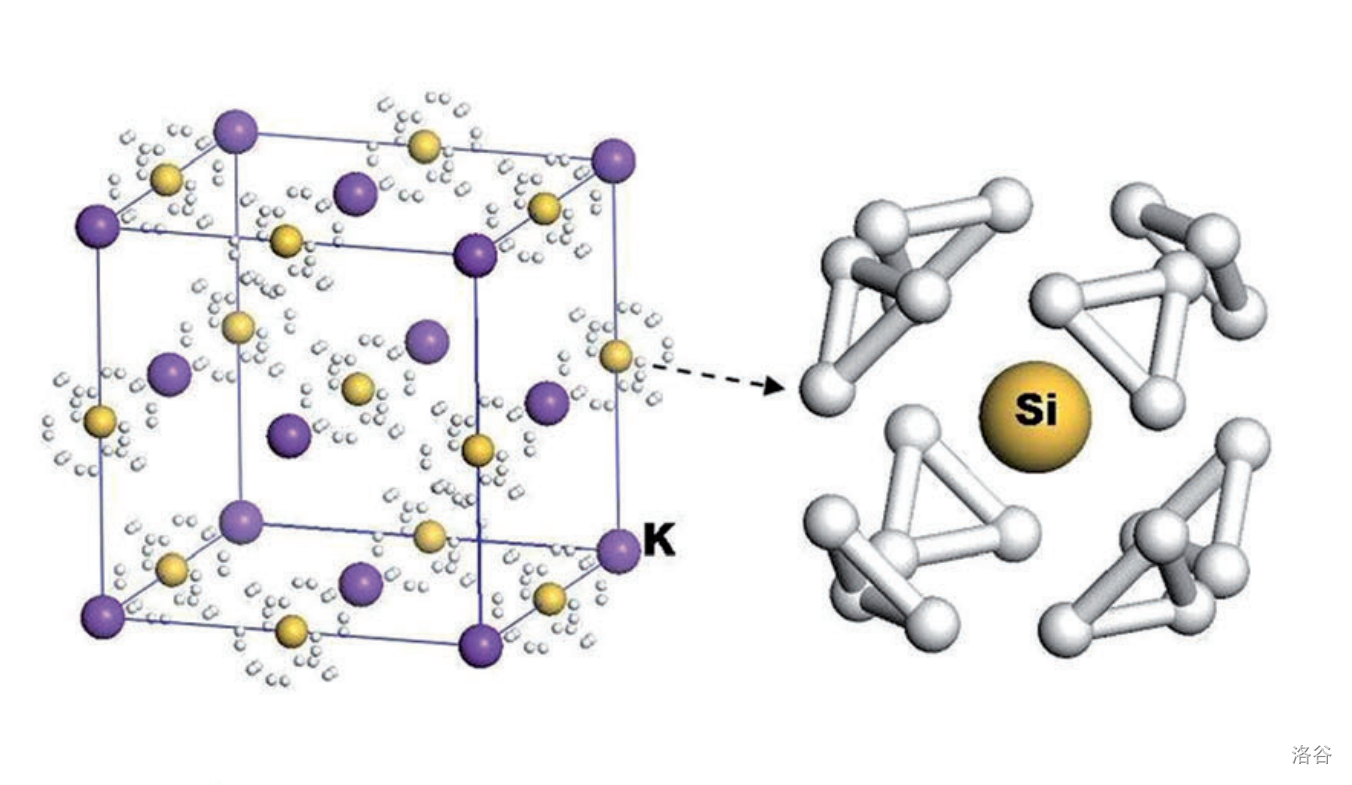
化学家们很早就意识到某些硅与金属形成的硅化物中会出现一些不同寻常的阴离子。比如硅与钠的化合物硅化钠()拥有非常多的比例,除了遵守化合价的 以外, 算是比较常见的。结构研究证明,这个化合物其实应该写成 ,即四硅化四钠。这个物质中只含有一种三棱锥形的阴离子:,它是白磷的等电子体:
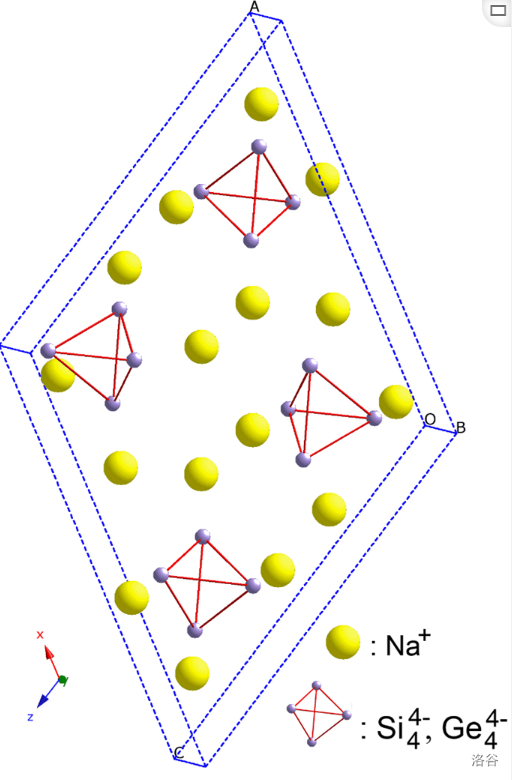
(上图:(或 )的晶体结构)
阴离子 就是典型的硅负离子原子簇。当然,在这个家族里还有一些更有趣的角色。
比如,同样是 个 原子,我们还能得到带 个负电荷的阴离子 。在惰性容器中加入摩尔比为 的 和 粉,真空强热,最后可以得到一种带有金属光泽的固体四硅化三钡():
这种物质中唯一含有的阴离子即是蝴蝶形的 ,离子中含有两个三元环,如下图:
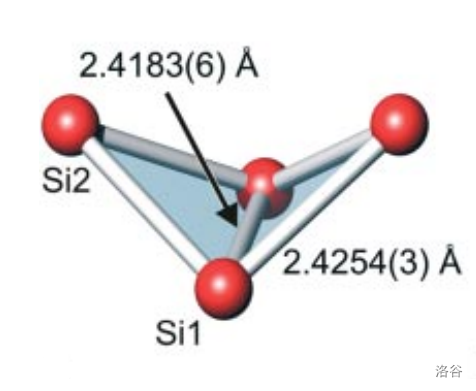
(上图: 的结构)
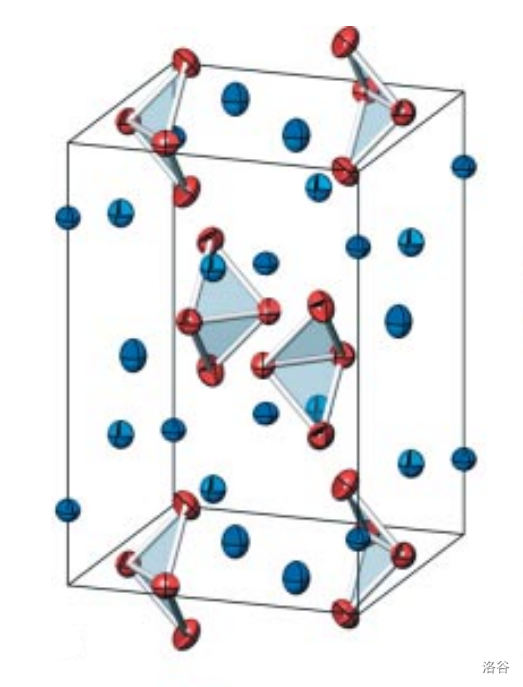
(上图: 的晶体结构,红色为 ,蓝色为 )
或许你觉得带 个负电荷也挺正常,那我们其实还可以更进一步。将一定比例的 和 粉混合后真空强热,可以得到七硅化十二锂()。结构研究证实,这种物质其实应该写成 $\ce{Li^+_{~24}[Si5]^6-_{~2}[Si4]^12-}\ce{Si5^6-}\ce{Si4^12-}$ 两种离子,结构如下:
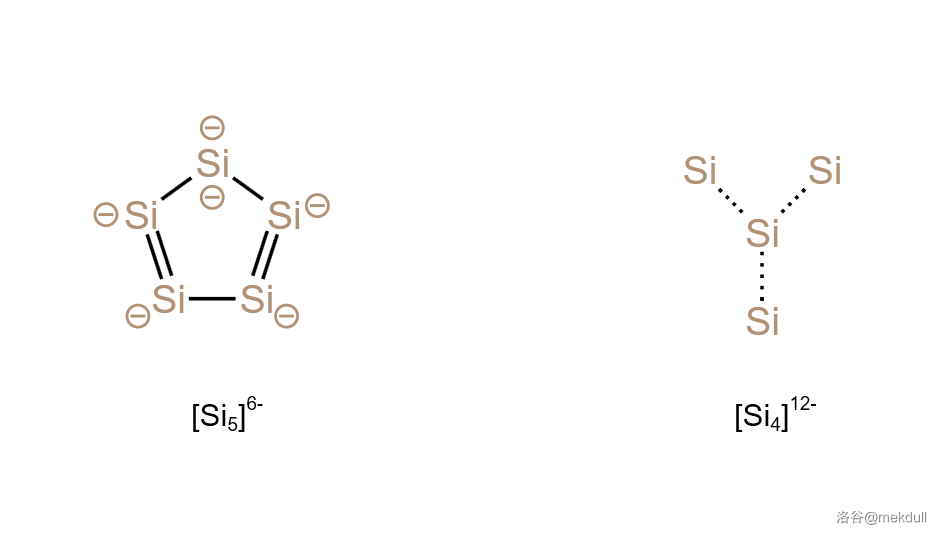
(上图: 和 的结构,后者省略负电荷)
可以看到,两种离子都是平面结构。 的中心有一个 的离域大键,具有芳香性(类比茂负离子 );而 是一个“”形,键角是完美的 ,三个键的长度均相等。它内部的成键直到今天(截至 )也没人说得清,反正常规的化学键肯定是不可能的。
值得注意的是, 也可以像 一样形成夹心配合物。下图是 的晶体结构,其中有一个 就被夹在两个 之间:
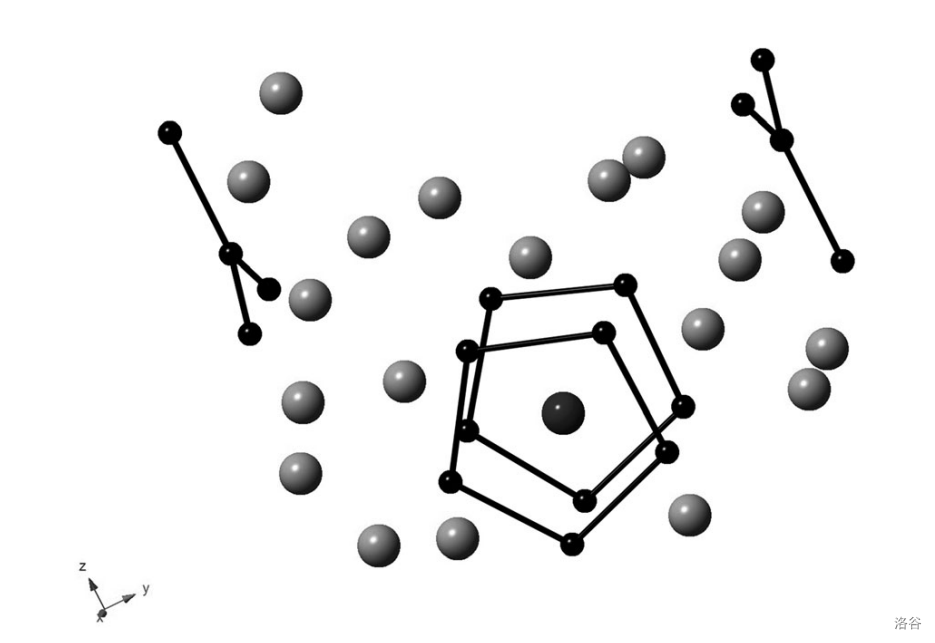
事实上,晶体中存在许多 的长链,你也可以把这些链看成晶体的骨架。
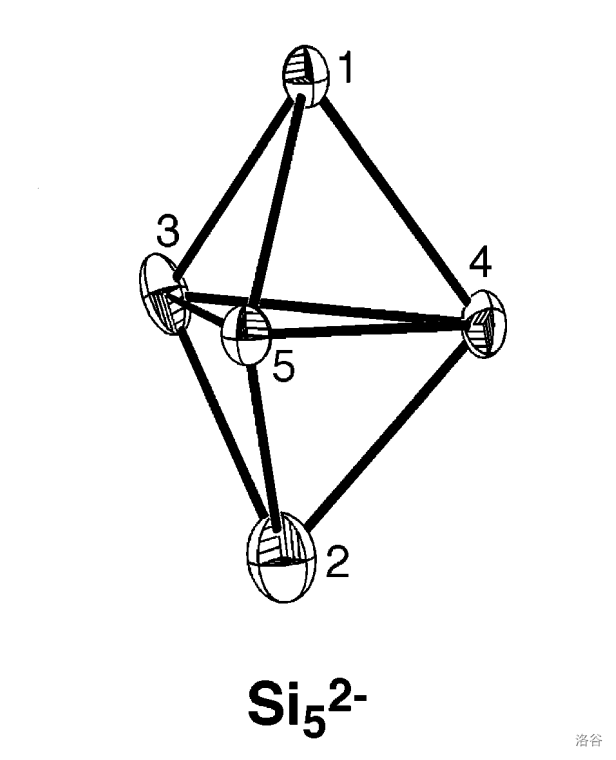
这时可能有人要说:刚才说的那些都太小了,有没有大一点的呢?答案是肯定的。比如,将摩尔比约为 的钾和硅在坩埚中高温烧结,可以得到十七硅化十二钾()。这种物质中有两种阴离子,除了刚才提到过的 外,还有一种巢式结构的阴离子 ,如下图:
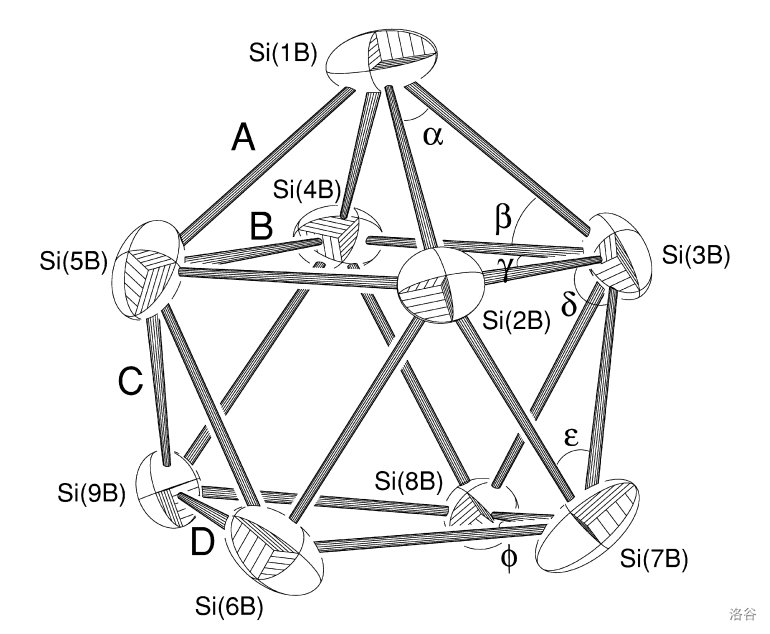
(上图:硅负离子原子簇 的结构)
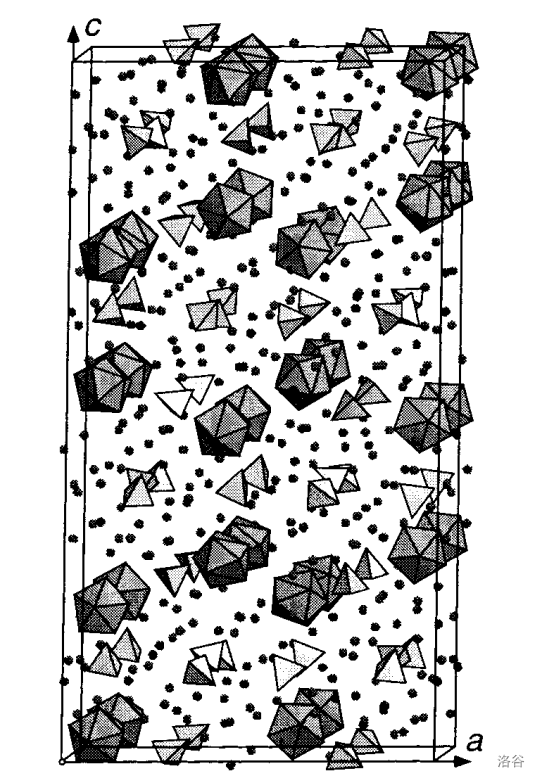
(上图: 的晶胞,图中浅色为 ,深色为 ,小黑点为 )
与 类似的是,我们至今也没有完全搞定 的成键。这个离子还有一些令人疑惑的性质,比如它可以被氧化。在液氨溶剂中加入一些 穴醚,然后把 溶解在其中,可以得到暗红色的溶液。加入 后溶液分层,几天后可以在 中结晶出一种美丽的暗橙色晶体 :
(注 : 表示被 穴醚配位的钾离子; 表示 穴醚。)
(注 :在实验中同时结晶的还有一种物质,阴离子似乎是 ,但我没有找到关于这种物质的深入研究记录。)
这种物质的阴离子是 ,也就是 被氧化的产物。这个反应的氧化剂其实是 ,它夺走了 的电子形成了氨合电子(类似于碱金属溶于液氨中)。回到 ,它是一个罕见的单电子离子,具有明显的顺磁性,结构如下:
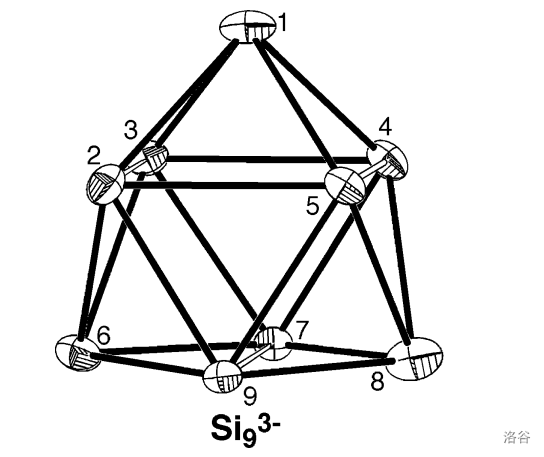
看起来和它的父亲 差不多,唯一的不同是 号和 号 原子之间的距离变近了一点。如果我们变本加厉地向刚才的液氨溶液中加入一个弱氧化剂(比如 ),则 还能再失去一个电子,得到 :
随后在吡啶中可以结晶出美丽的暗黄色晶体 。阴离子 的结构如下,和上面的 相比,它的 号和 号 原子之间的距离变得更近,整体也成为了闭式结构:
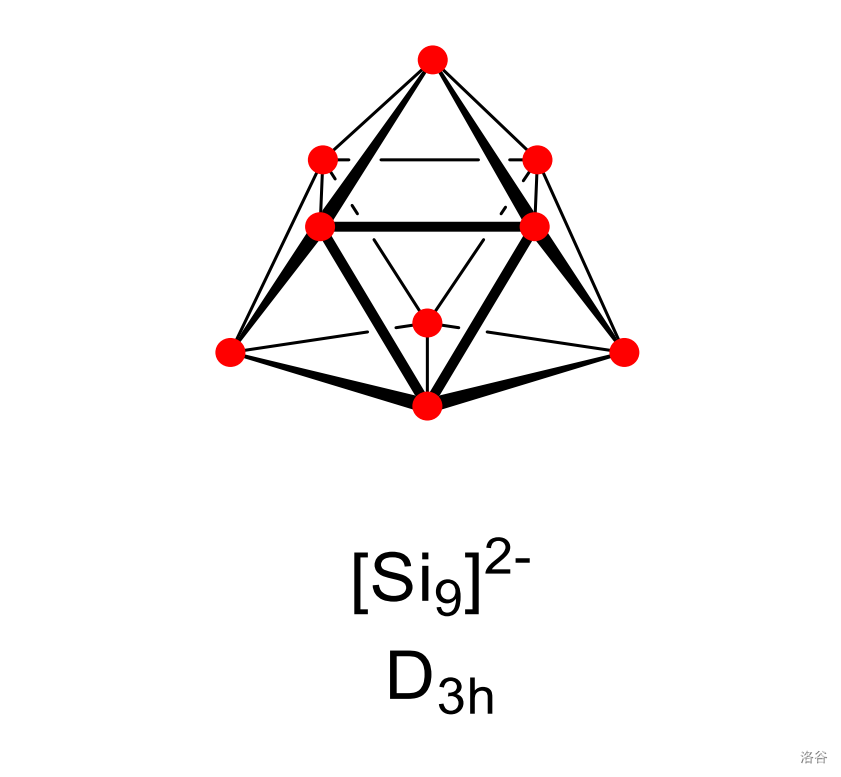
上面这些还是基础操作。事实上,各种硅负离子原子簇溶于液氨形成的体系非常复杂。 年,一些化学家发现在液氨中存在如下平衡:
经过一番操作后,他们得到了含有 的晶体。这一发现告诉我们:硅负离子原子簇是可以被质子化的,而质子化后的产物,自然就叫做硅烷负离子(或者叫硅氢负离子)。
在打开思路后, 年,化学家们又发现 在液氨中也会质子化,而且平衡常数极大,几乎是不可逆的:
对 的结构检测表明,这个离子中存在氢桥键。或者更确切的说,是三中心二电子()氢桥键。如下图所示:
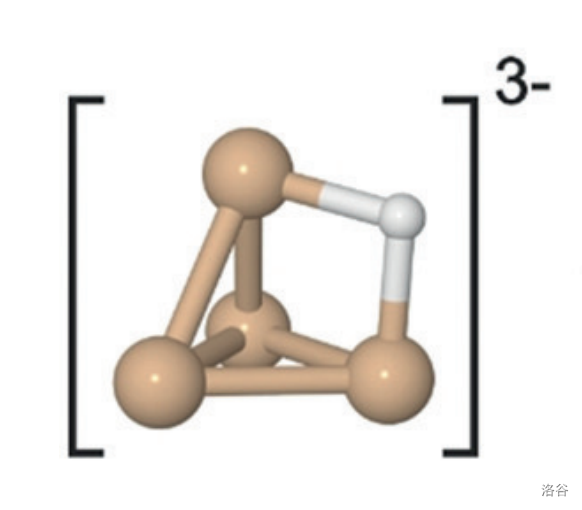
(上图:黄色为 ,白色为 。关于氢桥键的详细介绍,请见这篇文章)
这项重大的发现告诉我们:硅也有形成氢桥键的能力。同时,这为解释硅化合物的反应机理提供了新的思路。现已证明,硅烷在热分解过程中会经过大量的氢桥键中间体。
只能说,硅负离子原子簇作为一个新兴的领域,值得讲的东西实在太多了。篇幅所限,让我们暂且结束对它们的讨论——前方还有更奇妙的物质等着我们。
硅烯、硅自由基与硅卡宾
硅原子体积大,故而 轨道“肩并肩”的重叠能力弱,因此难以形成多重键。这个论断非常经典,但有些人说硅“不能形成多重键”就非常扯了。早在 年, 和 等人就先后合成了两个含有硅硅双键()的物质,从而正式确定了硅烯(衍生物)的存在。
我们今天可以很方便地重复他们的实验。在低温的乙二醇二甲醚(,)中用 还原 ,可以得到无色晶体 。随后低温下用汞灯照射这一物质,可以几乎定量地得到一种极其鲜艳的黄色晶体 :
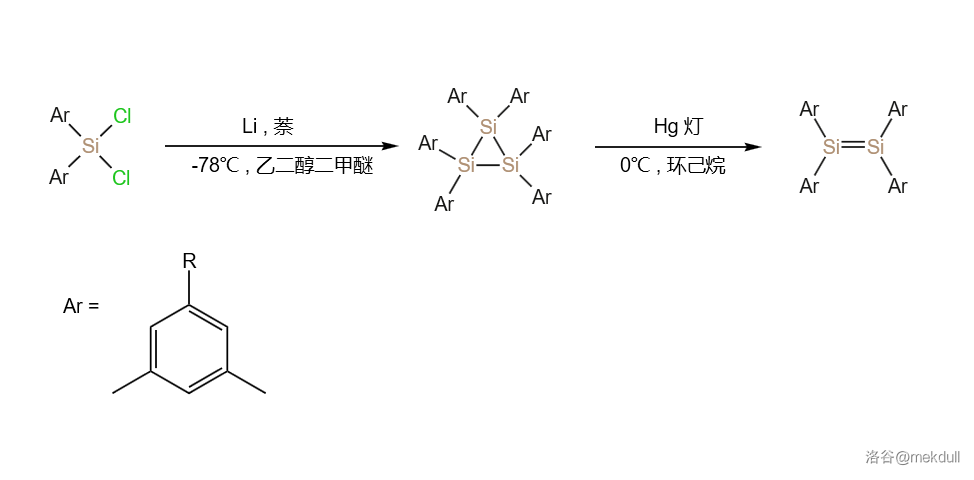
年之后的今天,这个反应留给我们的问题仍没有解决。比如,拥有三元环结构的 非常稳定,室温下既不被氧化,也不被水解;如果隔绝空气,它可以加热到 以上不分解。它的结构也很奇怪,那个三元环的环内电子高度离域,与周围苯环的电子相互流通;那个三元环甚至不是等边三角形,如下图:
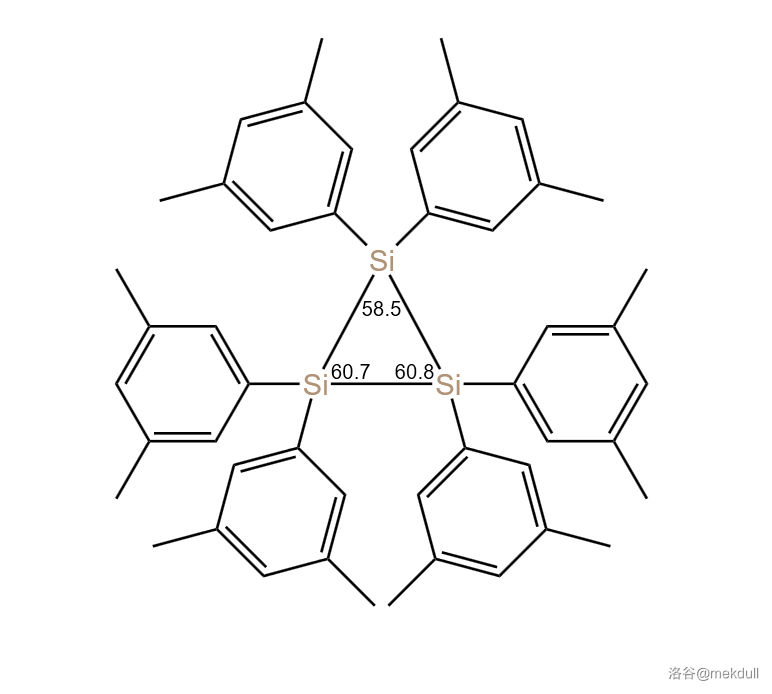
(上图: 的分子结构示意)
而随着这一领域研究的日渐深入,化学家们又得到了更神奇的物质。用钾石墨()还原一种新戊硅烷的衍生物,会发生如下的反应:
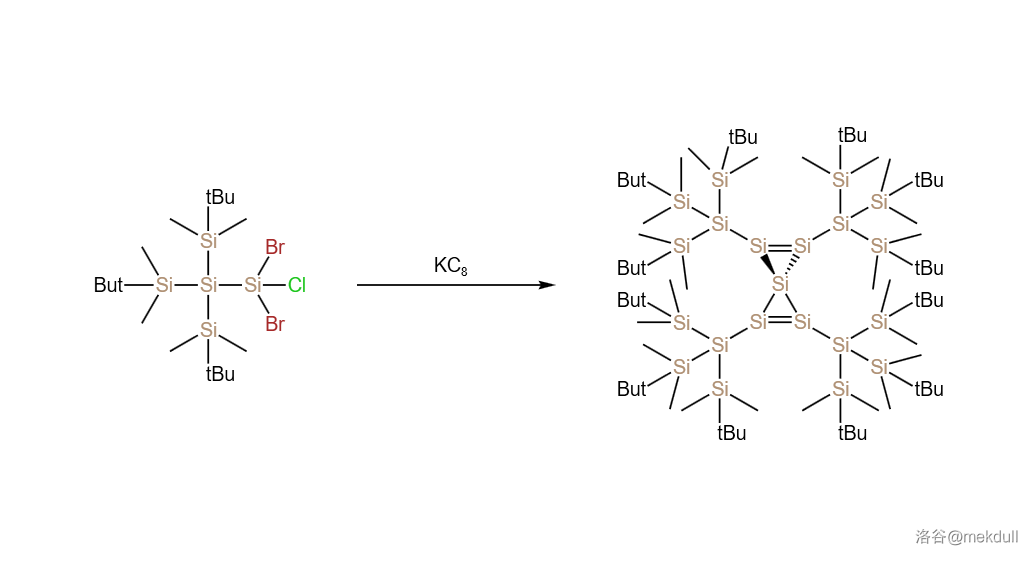
产物 是一种非常漂亮的酒红色晶体,也是迄今为止得到的最大的稳定硅原子簇之一。它的核心是一个螺环的戊硅二烯结构,拥有两个 键和两个三元环。奇怪的是,这东西的热稳定性却很好,在 的高温下也没有分解迹象。有研究表明,核心的 个硅原子之间的键有较大的离域成分。
用类似的还原方法,我们也可以制得环丙硅烯的衍生物:
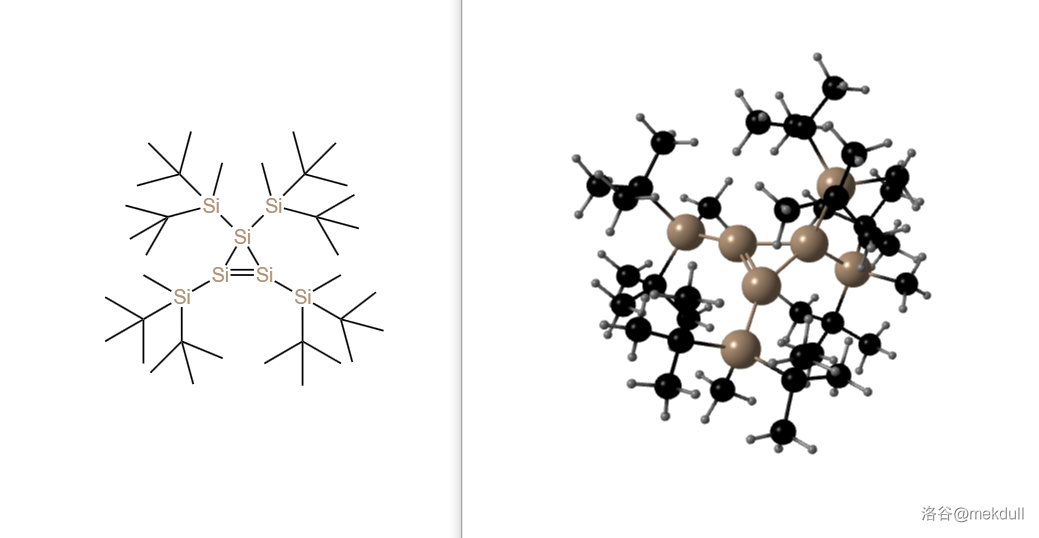
(上图: 的分子结构)
这种橙红色的晶体在空气中会迅速氧化,但如果隔绝空气,那也能耐 以上的高温。但这并不是它最有趣的地方。
年, 等人将这个物质与硅阳离子(它们用的是 )反应,以很高的产率得到一种环四硅阳离子,在溶剂苯中呈现出血红色。如下图:
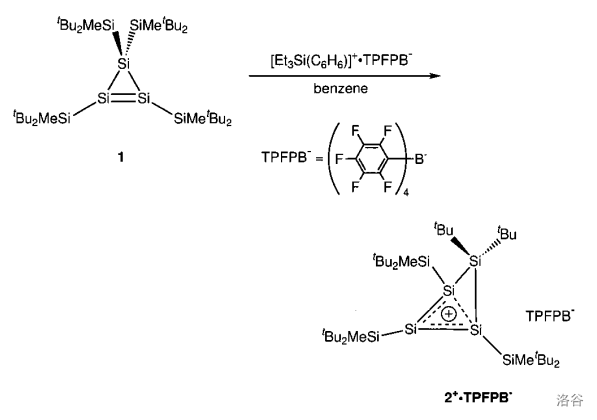
从溶液中可以得到含有该阳离子的黄色晶体。对其结构的研究表明,有 个硅原子在同一平面内,另一个硅原子则是“翘起来”的;正电荷不属于单个硅原子,而是被平面内 个硅原子“共享”。这三个硅原子间虽然不成环,但它们之间存在一个 的离域大键,且具有芳香性。这种“跨越原子”的特殊芳香性,被称作同芳香性。
没错,这是第一个具有同芳香性的无机物,也是特殊芳香性在无机化学中也存在的实证。
你以为这就完了?不。在乙醚中用硅负离子(在这里选用的是 )再次处理这个阳离子,最后可以得到一种极其漂亮的紫红色结晶 ,如下图:
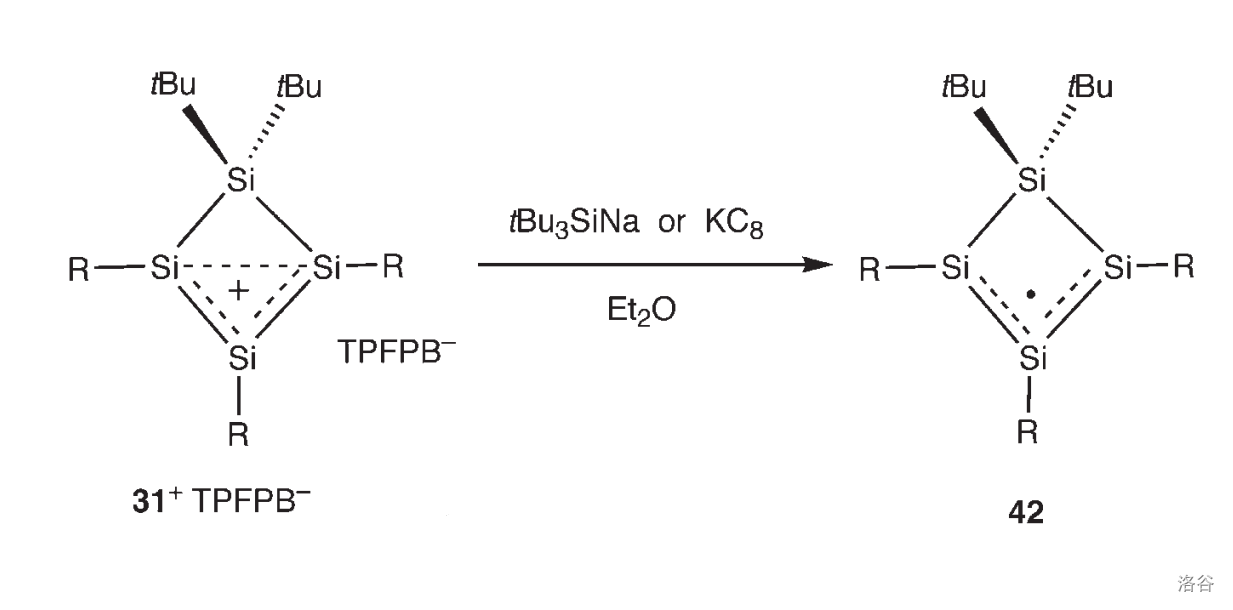
没错,它就是许多这一领域的化学家梦寐以求的稳定自由基,确切的说,是稳定硅自由基。各种分析明白无误地证明:在这个化合物中有一个 原子携带了单电子。作为硅自由基,它可以非常高效地切断碳卤键()从而引发后续的自由基反应,也可以对某些特定的基团进行自由基氧化,因此在有机化学界受到了重视。
更令人兴奋的是,对于一个自由基来说,它有非常高的稳定性,在室温下只要隔绝空气就能长久保存。但是,这种稳定性究竟来自于哪里,目前还说不清楚。
与硅自由基类似的是所谓的硅卡宾。“卡宾”本是有机化学中的术语,是指碳原子上有两个未成键电子的高活性中间体()。硅卡宾的概念起自 世纪中期。当时,人们发现在高温下 可以与 粉在高温下发生中和反应,从而得到二氟化硅():
作为第一个被仔细研究的硅卡宾, 要比那些碳卡宾稳定得多。在 以上的高温下,它可以一直保持稳定;但如果把温度降下来,它会缓慢地发生聚合反应,得到聚二氟化硅():
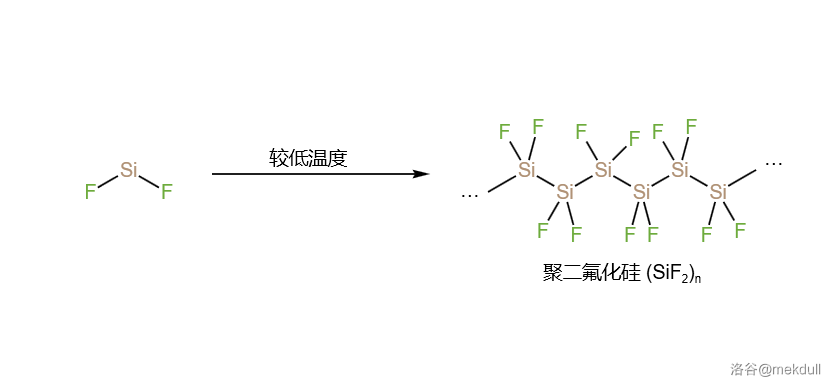
它在低温下是橙色的,但在室温下就会变为白色。这个聚合物的骨架完全由硅原子长链构成,因此有些文献中把它称为“”硅基聚合物,以便和硅橡胶(化学成分为聚硅氧烷,)之流区分。
这种聚合物的结构与聚四氟乙烯类似,物理性质也有些类似。它极其柔软但又极其坚韧,同时具有极好的弹性,只可惜容易水解的性质限制了它的应用。另外,虽然这种物质中有非常长的硅链,但因为本身是个聚合物,不是纯净物,因此也不能说是“硅链最长的化合物”。
回到硅卡宾的话题。它们与碳卡宾的一个相似之处是都能与烯烃发生环加成反应,得到三元环状的化合物:
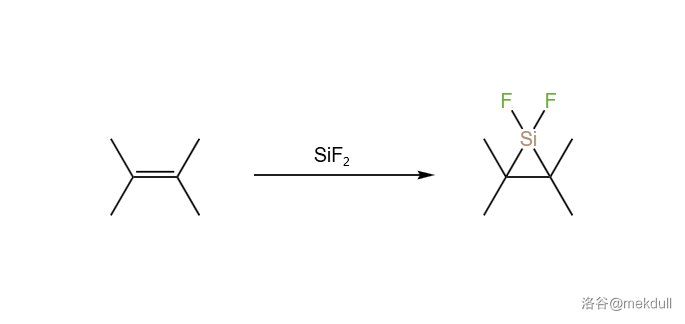
当然, 玩出的花样不止这些。它与碱金属氟化物(比如 )反应,可以得到氟亚硅酸钠()等含有 价 的盐。反应如下:
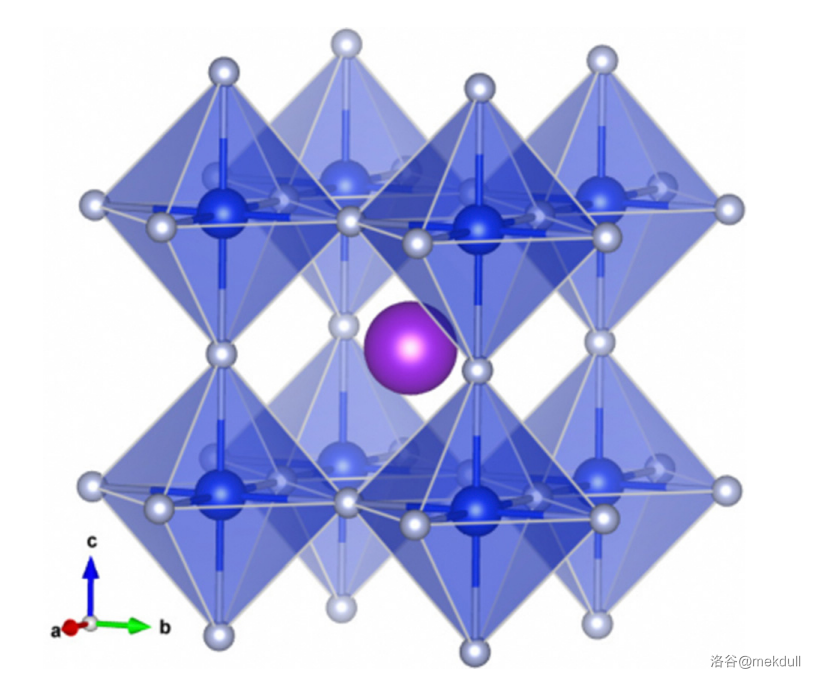
(上图: 的结构,其中蓝色:,白色:,紫色:)
在这种物质中,每个 原子都是经典的六配位,而每个 都与两个 结合,构成了立方体状的骨架。但是,这种物质对热并不稳定。事实上,稍稍加热它就会歧化分解:
更有人称,如果用 和 反应,可以得到 价 的盐氟次硅酸钠()。篇幅所限(主要是资料太少),我们暂且不讨论这货,而是把目光投向一个美丽的设想。这个设想,叫做六硅苯(,)。
六硅苯的设想与硅炔
人类对苯()结构的认识可谓是一首宏大的史诗。从凯库勒式()开始,到向心结构式、余价结构式( 世纪晚期),到共振结构式、离域键、芳香性、休克尔规则(),再到分子轨道理论解释、自旋耦合价键理论( 世纪中期),整整跨越了 多年的光阴。
但很多人不知道的是,对于苯类似物的研究同样历史悠久。时至今日,我们已经得到了无机苯()和硼氧苯()等类似物(注意:新近的研究认为这两种物质并没有芳香性)。 世纪初,在门捷列夫()建立了元素周期表之后,人们开始研究与碳同族的元素是否能形成类似苯的结构。于是,六硅苯()的设想便应运而生了。
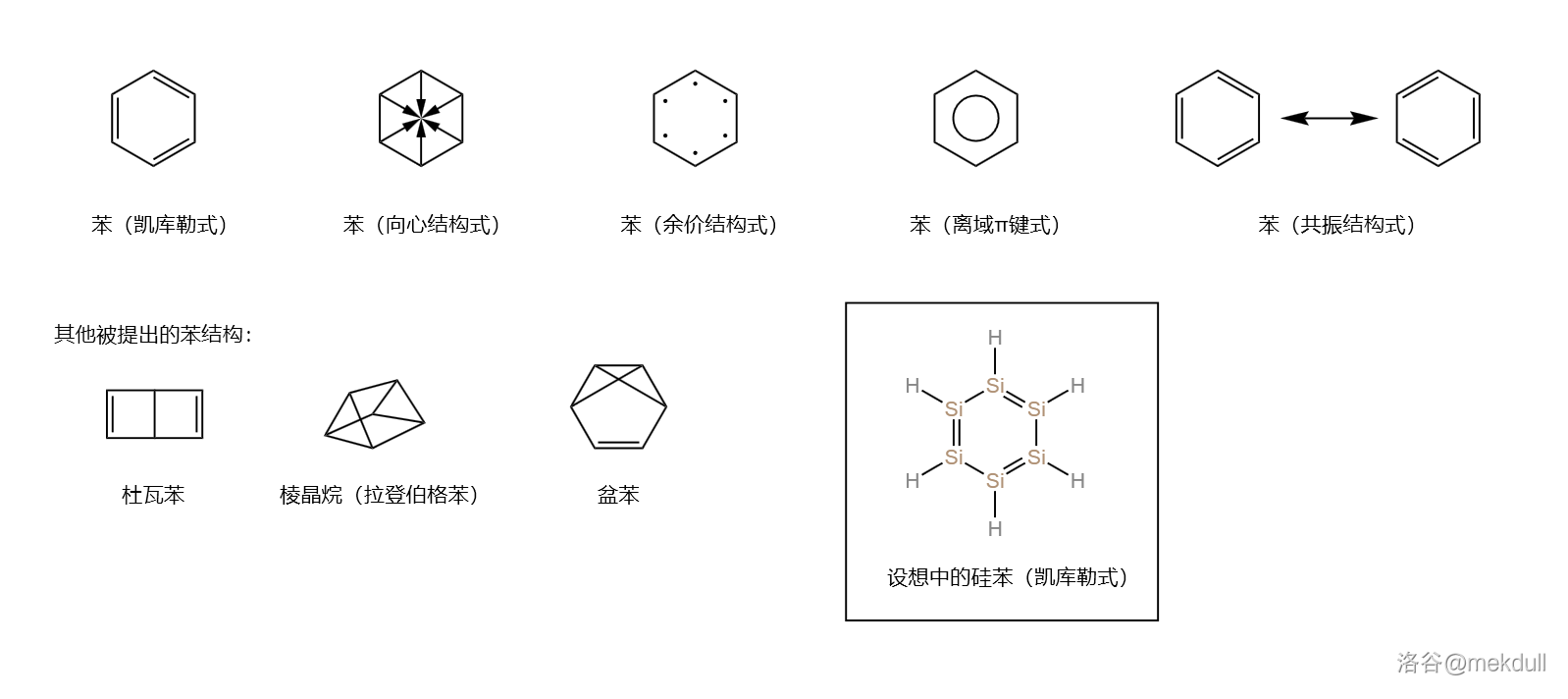
可是,上文已经提到,人类到 年才合成了第一个含有 键的稳定化合物。所以,在这个设想提出之后的几十年,对 的探索都没有什么进展。
到了 年,人们才合成了首个 的同分异构体棱晶硅烷的衍生物。用 还原 或 ,可以得到一种美丽的橙色晶体,即是 (注: 指芳香基团;原料用 会导致产率很低):
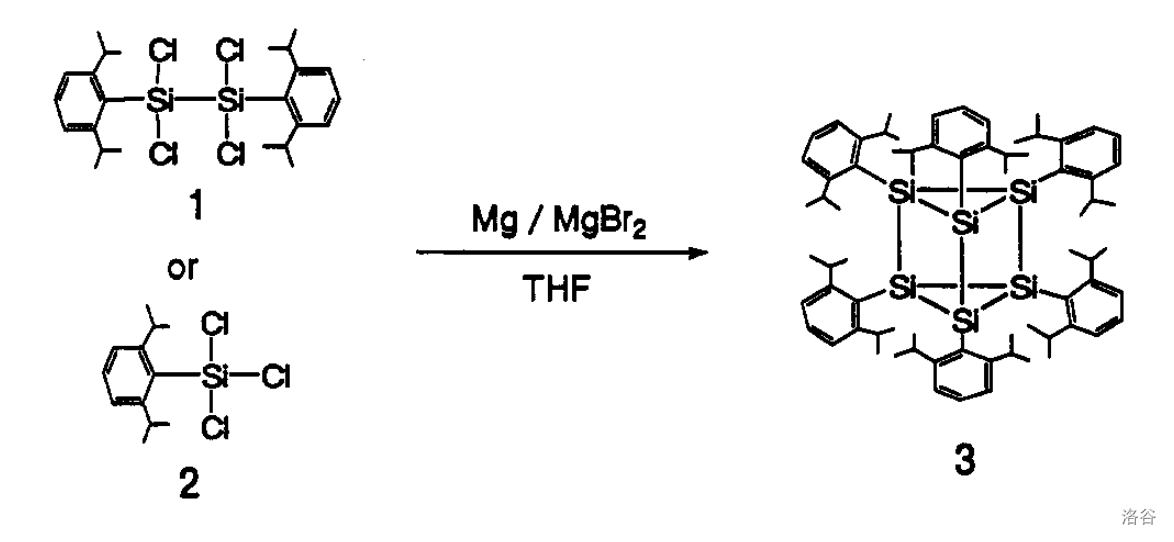
这种物质非常稳定。它在室温下不被空气氧化,也不被轻易水解,同时还具有很高的热稳定性。受此启发,人们开始对 的最稳定结构进行大量理论计算。结果表明:类似于苯的平面大键结构对于硅来说或许并不是最稳定的。
无独有偶, 年,人们又合成了一种结构更加抽象的 。用 还原 (一种环丙硅烷的衍生物),可以得到黑绿色的晶体 :
分析表明,这种物质的结构与苯并不一样。它包含三种化学环境的硅原子,一种 与一个 基团相连,另一种 与两个 基团相连,还有一种不与 基团相连,是所谓的“裸硅原子”,如下图所示:
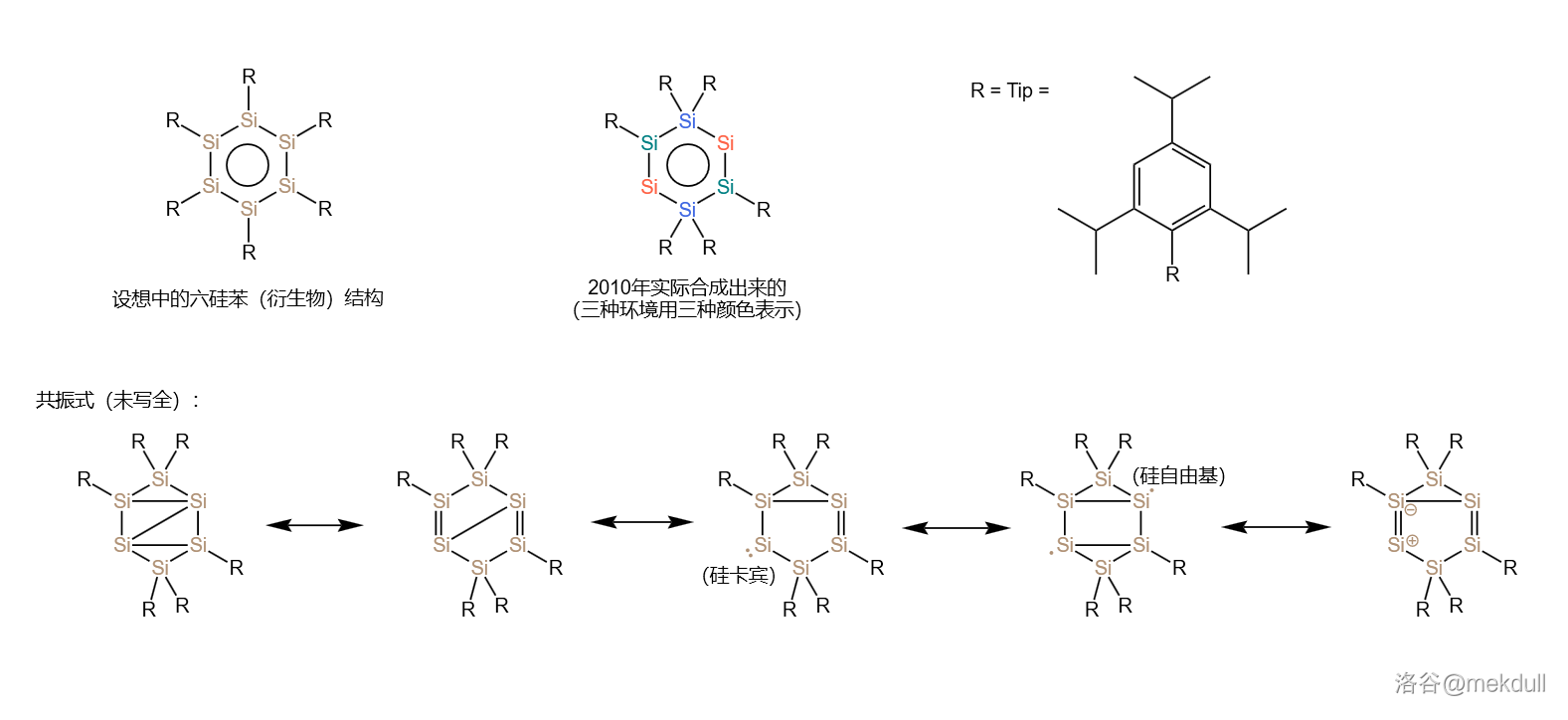
它的实际结构如下图所示, 个 原子构成了类似于椅子的形状,其中有 个 原子构成了平面矩形:
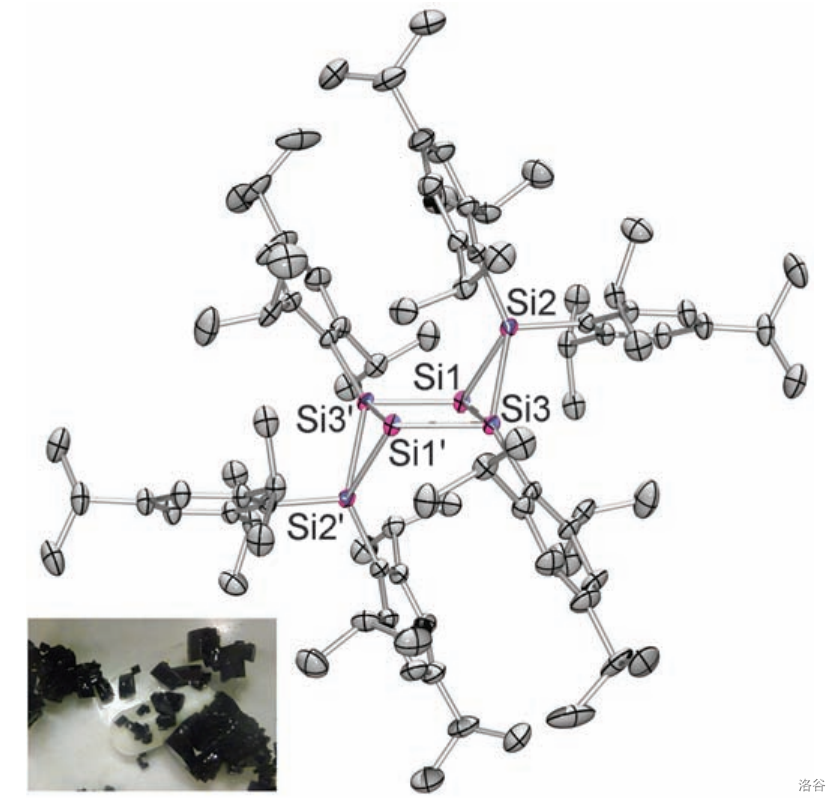
(注:左下角是这种物质实际的样子)
这四个 原子之间存在一个 的离域键(对比一下,苯的离域键是 ),且具有芳香性。后来,这种涉及 键、 键、卡宾原子的复杂非经典芳香性被命名为异变芳香性()。
这种芳香性使得 也有着不寻常的稳定性,可以在空气中保存较长时间。但是,如果对它进行强光照射,那么它就会逐渐发生分子内的硅骨架重排,得到一种橘黄色的晶体:
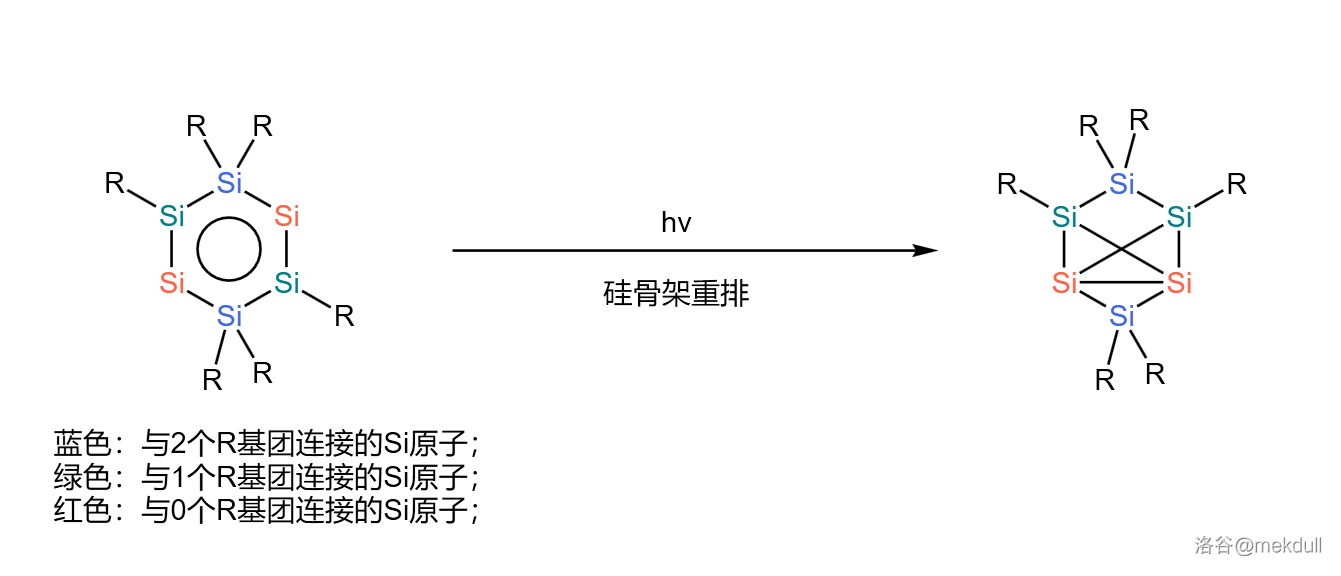
这种橘黄色物质热稳定性更好,隔绝空气的情况下可以加热到将近 不明显分解。研究表明,它的结构可能是 中能量最低的。但是,它似乎直接失去了芳香性,以至于动力学惰性很差,可以在空气中迅速被氧化。
这么说来,我们就真的不可能得到六硅苯了?并不是。虽然在硅这里,苯的结构或许并不稳定,但不稳定不等于不存在。直到今天,仍然有很多科学家在向这个方向努力——六硅苯,已然成为了硅化学中的“圣杯”。
当然,也有一些化学家从另外的角度做出了努力。 年, 等人首次得到了稳定的含有硅硅叁键()的物质,自然的,这类物质被命名为硅炔。具体来说,方法与对应的碳化合物类似,即用金属还原卤代硅烷:
一个比较有意思的事情是,我们都知道碳碳叁键()是直线型的,但硅硅叁键并不如此。下图是 (第一种被制得的硅炔,一种漂亮的翡翠色晶体)的分子结构,可以看到硅硅叁键呈现出反常的折线型,并用红笔标出了那个反常的键角:
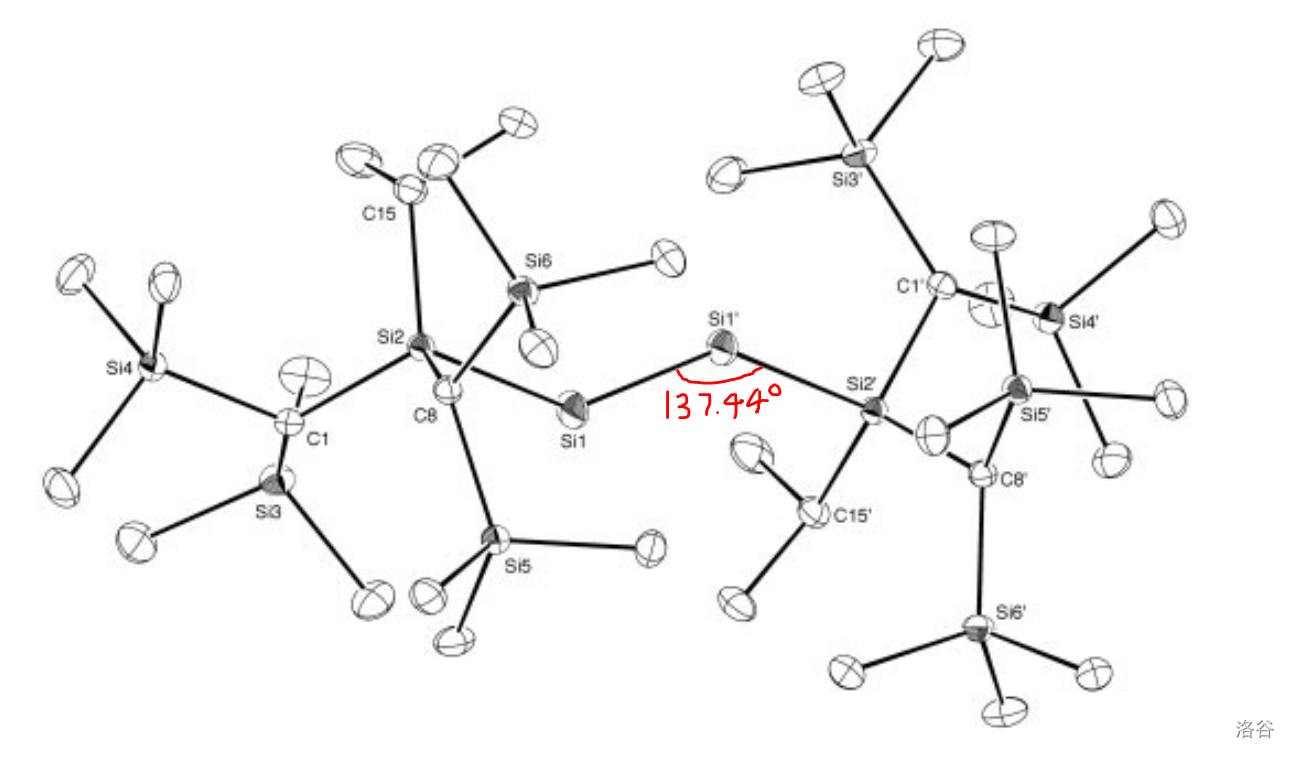
在此之前, 等人已经合成了铅炔(含有 )、锡炔(含有 )和锗炔(含有 ),在它们身上也观察到了类似的键角。所以,实际上在整个 族元素中,只有碳形成的叁键是直线型的,换言之,那个我们习以为常的键角,才是真正的特殊情况。
就像预料的那样, 键具有很高的反应活性。我们都知道,乙炔()在高温下可以三聚为苯,那么更活泼的硅炔行吗?至少在目前,我们并没有观察到。但是,硅炔可以和苯乙炔()等发生交叉聚合反应:
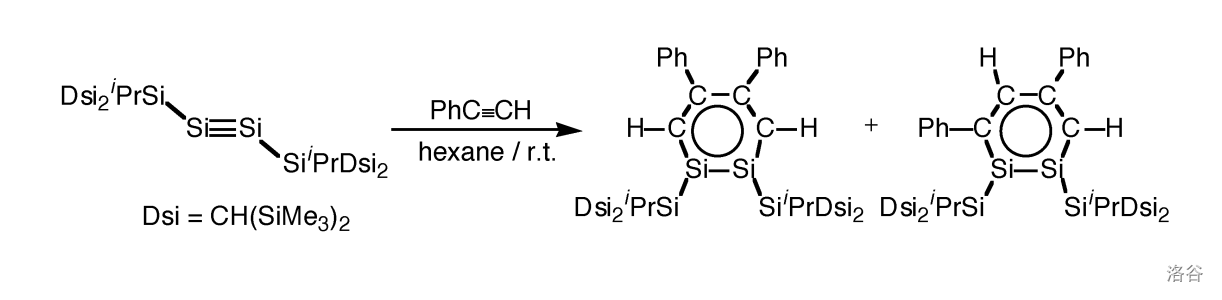
得到的两种产物都是黄色晶体,唤作邻二硅苯()。由于 原子的体积比较大,所以这两种物质具有平面变形六边形结构。
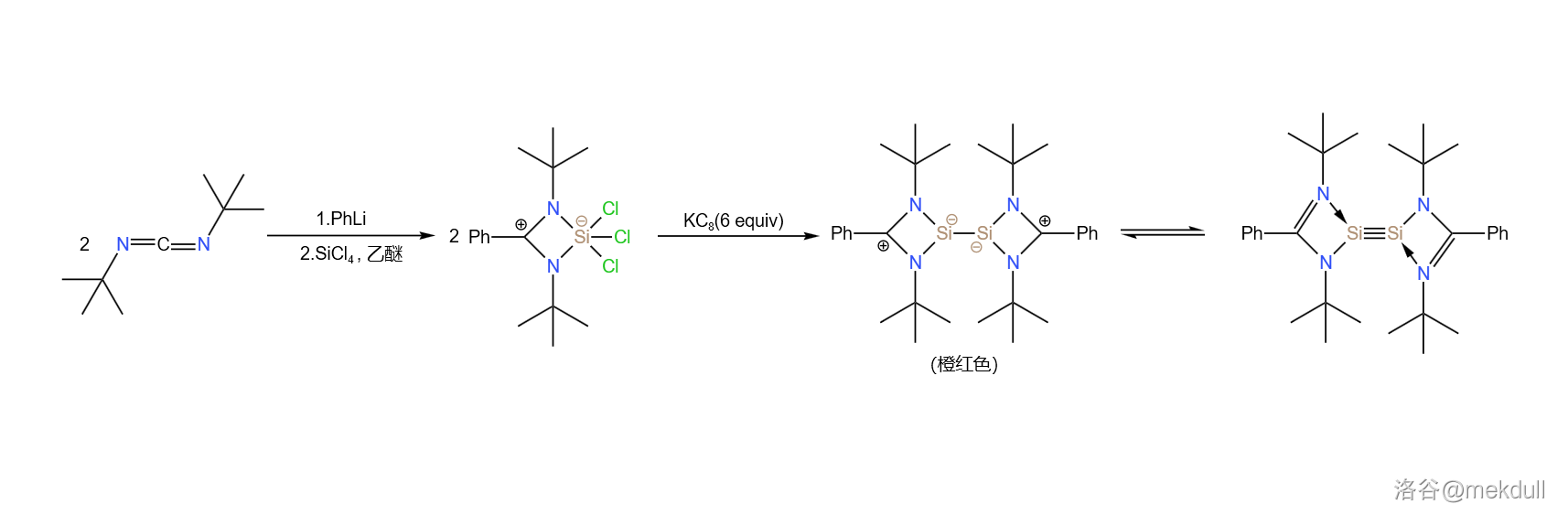
对应的,对二硅苯()也被成功制得了,思路也有些类似。从有机化学中的一种常用试剂()出发,先用强碱苯基锂()和 处理,得到一种同时含有五配位硅原子和碳正离子的奇怪物种;随后再用石墨钾()还原,得到一种橙红色晶体:
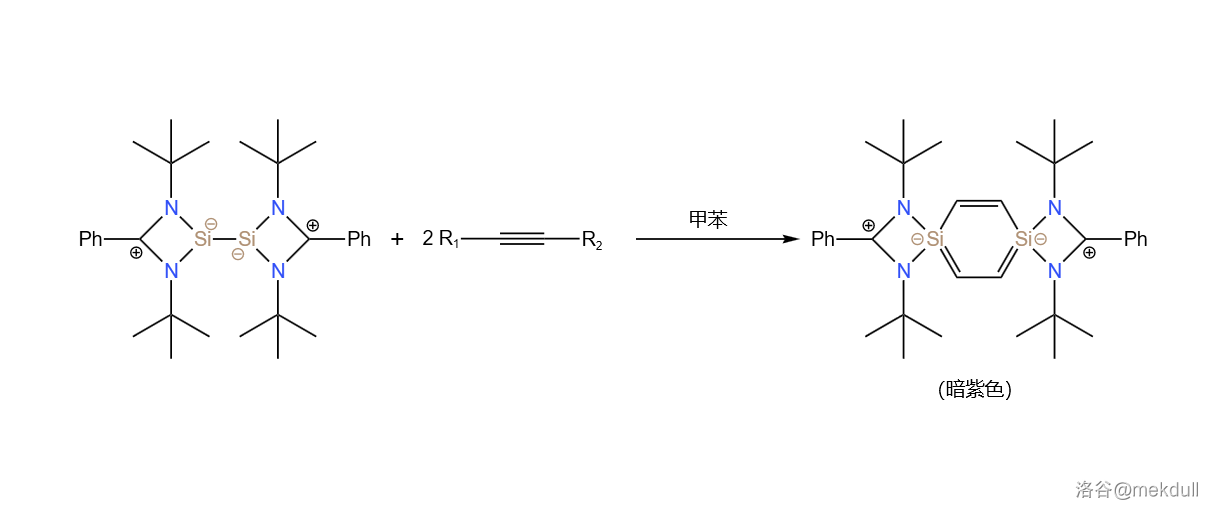
最后,将这种物质与炔烃交叉聚合,即可得到一种美丽的暗紫色晶体,也就是我们所说的对二硅苯:
相应的,二硅盆苯、二硅杜瓦苯等物质也已经被制得。但是,三硅苯及更多 原子取代的苯直至今天也没有可信的制取记录。 原子的取代似乎会降低苯环的稳定性。证据有很多,比如二硅苯普遍容易被氧化、硫化,甚至是硒化,有些物种还有异构为杜瓦苯、盆苯结构的强烈倾向,等等。
六硅苯究竟是真实存在的,还是只是一个虚无缥缈的幻影?这个问题至今依然扑朔迷离。
结语
我们在上面已经讨论了很多关于硅烷和硅原子簇的话题,但这恐怕也只是这个宏大世界的冰山一角而已。相信很多人都注意到了,上文中提到的很多物质都是在这个世纪或者是上世纪末才被合成、研究的。确实,人类对于这类物质的认识起步很晚,这个新兴的化学领域中充满了难题与未知,而这也是最吸引我的地方。
一个看似简单的问题是,为什么我们合成的大多数硅原子簇都有各种美丽的颜色?如果想让自己看起来有水平一点,我们还可以问:为什么硅原子可以比较容易地形成一些张力极大的结构?
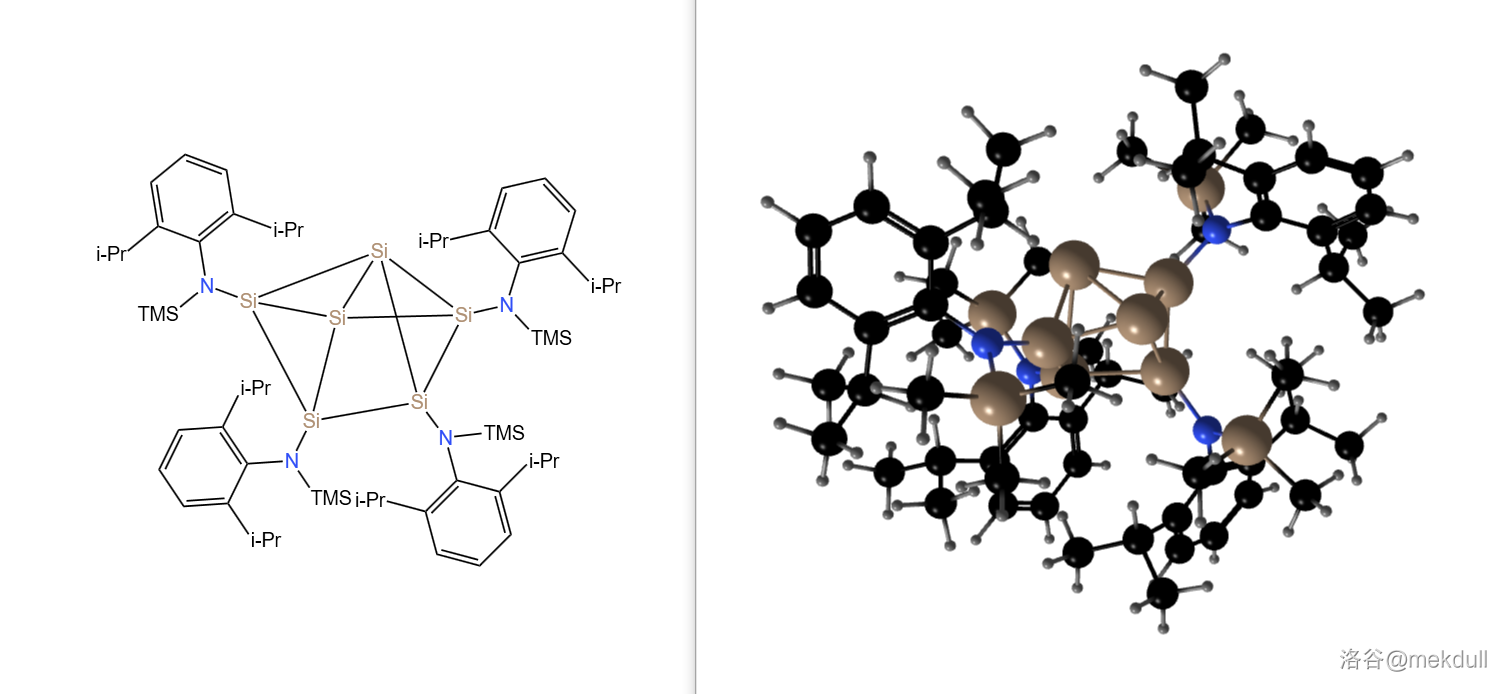
(上图: 年合成的黄色晶体 ,分子中心的 个 原子构成了 个三元环和 个四元环。在没有空气存在时,该物质在 下不分解)
对于一个新兴的研究领域来说,难题总是会随着研究的深入而不断涌现。 年,有人合成了一种奇怪的物质,其中所有 原子的氧化态都是 ,且拥有一个 键。这一成果发表在了 杂志上,并引来了广泛的关注:
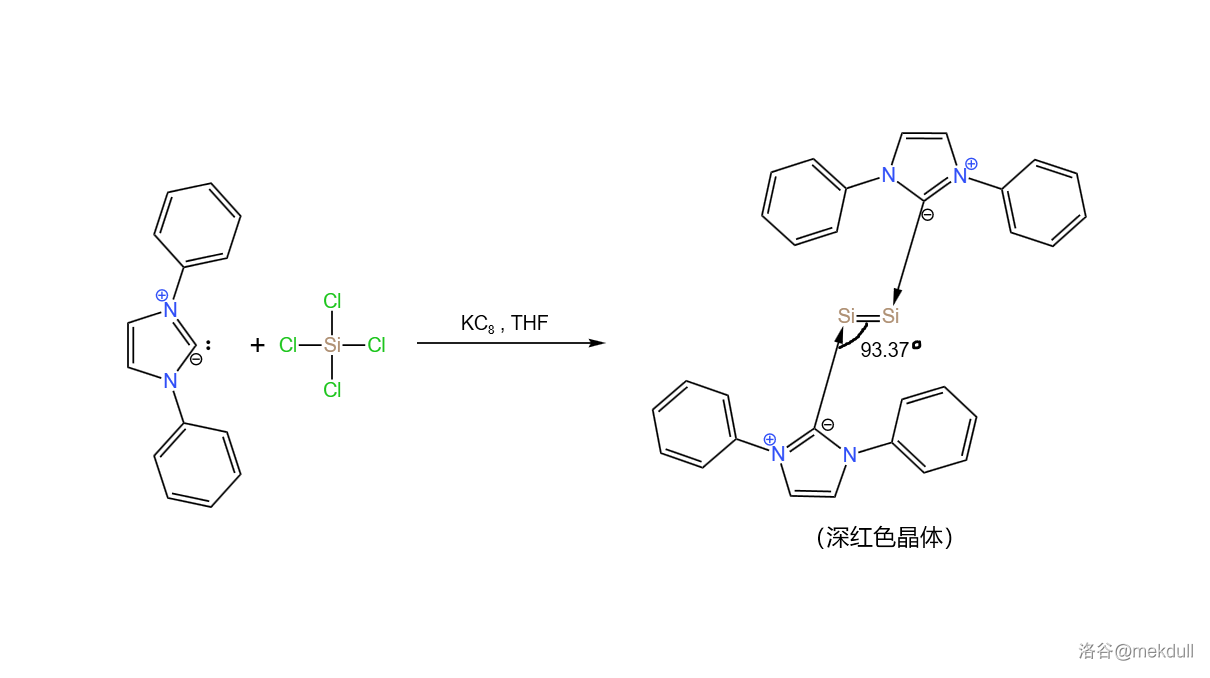
在常温下无空气存在时,这种美丽的深红色晶体可以稳定存在。这种物质的结构让人们十分困惑,尤其是那个不寻常的接近 的键角(上图中有标出)。当然,像这样的物质还有很多,篇幅原因,就不一一列举了。
由于硅在元素周期表中的位置,它的化合物有点像同族的碳,但也有点像对角线上的硼,而在不少地方又是自成一派。与 最像的莫过于在它下方的锗()元素。事实上, 族较重的元素()形成的簇状化合物都类似于 ,以至于有人提出了一个更大的研究领域:碳族簇状化合物()。
目前,最大的碳族簇状化合物是 年合成的黑色晶体 ,其核心是一个由 个 原子构成的复杂多面体:
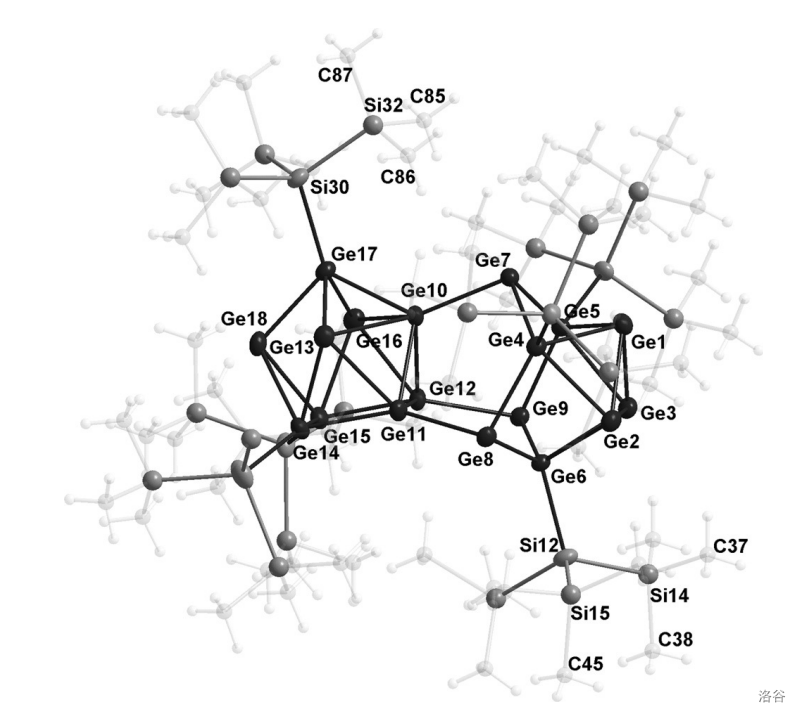
(上图:黑色:,灰色:, 和 被虚化)
(注: 元素还可以形成一系列可以表示为 的链状聚合原子簇,由 个 单元连接而成,当 较大时晶体中没有固定的 值,所以我没有把它纳入“最大原子簇”的评比)
但是,这就到极限了吗?未必。我们的探索是没有止境的,谁也不知道在未来,这些奇妙的物质又会给我们带来怎样的惊喜。但不管如何,我们都应该毫无畏惧地踏入这片新的天地。不要把过去的观点当做金科玉律,也不要担心前方的风景会颠覆自己的认知,毕竟科学正是在不断的推翻和重建中才得以前进。
到了这里,这篇长达 字的杂谈也接近尾声了。硅,这种极为寻常却又极为神秘的元素,支撑起了地壳,支撑起了人类的信息时代,也支撑起了不少科幻作家对外星生命的想象。自我刚接触化学起,这种元素就一直吸引着我,但遗憾的是,关于硅化合物,尤其是硅原子簇类化合物的中文资料可谓少之又少。于是,我写下了这篇文章,希望能对你有所帮助。我会把参考资料写在最后,如果有兴趣可以进一步了解。
注:在这片文章中,有一些关键术语找不到中文翻译,因此采用的是我个人的翻译。我会把英文写在术语后面的括号内,如果有误,或者是已经有正式的译名了,还请在评论或私信中指出。不胜感谢!
参考资料
论文类
:Sekiguchi A. Disilyne with a silicon-silicon triple bond: A new entry to multiple bond chemistry[J]. Pure and Applied Chemistry, 2008, 80(3): 447-457.
:Hoch C, Wendorff M, Röhr C. Synthesis and crystal structure of the tetrelides A12M17 (A= Na, K, Rb, Cs; M= Si, Ge, Sn) and A4Pb9 (A= K, Rb)[J]. Journal of alloys and compounds, 2003, 361(1-2): 206-221.
:Shoemaker J, Burggraf L W, Gordon M S. An ab initio cluster study of the structure of the Si (001) surface[J]. The Journal of Chemical Physics, 2000, 112(6): 2994-3005.
:Robinson Brown A, Doren D J. Energetics of silicon hydrides on the Si (100)-(2× 1) surface[J]. The Journal of Chemical Physics, 1998, 109(6): 2442-2449.
:Wang S, Radny M W, Smith P V. First-principles electronic structure studies for the cluster modeled Si/Si (111) chemisorption system[J]. The Journal of Chemical Physics, 2001, 114(1): 436-444.
:West R, Fink M J, Michl J. Tetramesityldisilene, a stable compound containing a silicon-silicon double bond[J]. Science, 1981, 214(4527): 1343-1344.
:M. T. Frohlich, Synthesis and Utilization of Si6H12 and Si6X12 (X= Cl, Br) for the Generation of Novel Silicon Materials, 2017.
:Chotard J N, Tang W S, Raybaud P, et al. Potassium silanide (KSiH3): a reversible hydrogen storage material[J]. Chemistry–A European Journal, 2011, 17(44): 12302-12309.
:Tang Y N. Reactions of silicon atoms and silylenes[M]//Reactive Intermediates: Volume 2. Boston, MA: Springer US, 1982: 297-366.
:Schmidt D, Boehme U, Seidel J, et al. Cyclopentasilane Si5H10: First single crystal X-ray structure of an oligosilane SixHy and thermal analysis with TG/MS[J]. Inorganic Chemistry Communications, 2013, 35: 92-95.
:Masamune S, Hanzawa Y, Murakami S, et al. Cyclotrisilane (R2Si)3 and disilene (R2Si=SiR2) system: synthesis and characterization[J]. Journal of the American Chemical Society, 1982, 104(4): 1150-1153.
:Tillmann J, Moxter M, Bolte M, et al. Lewis Acidity of Si6Cl12 and Its Role as Convenient SiCl2 Source[J]. Inorganic Chemistry, 2015, 54(19): 9611-9618.
:Tillmann J, Wender J H, Bahr U, et al. One‐Step Synthesis of a [20] Silafullerane with an Endohedral Chloride Ion[J]. Angewandte Chemie International Edition, 2015, 54(18): 5429-5433.
:Bamberg M, Bursch M, Hansen A, et al. [Cl@Si20H20]−: parent siladodecahedrane with endohedral chloride ion[J]. Journal of the American Chemical Society, 2021, 143(29): 10865-10871.
:Gasevic T, Bamberg M, Wicke J, et al. Confined Lewis Pairs: Investigation of the X−→ Si20 Interaction in Halogen‐Encapsulating Silafulleranes[J]. Angewandte Chemie, 2024, 136(6): e202314238.
:Quéneau V, Todorov E, Sevov S C. Synthesis and structure of isolated silicon clusters of nine atoms[J]. Journal of the American Chemical Society, 1998, 120(13): 3263-3264.
:Heider Y, Scheschkewitz D. Molecular Silicon Clusters[J]. Chemical Reviews, 2021, 121(15): 9674-9718.
:Aydemir U, Ormeci A, Borrmann H, et al. The Metallic Zintl Phase Ba3Si4–Synthesis, Crystal Structure, Chemical Bonding, and Physical Properties[J]. Zeitschrift für anorganische und allgemeine Chemie, 2008, 634(10): 1651-1661.
:Köster T K J, Salager E, Morris A J, et al. Resolving the Different Silicon Clusters in Li12Si7 by 29Si and 6, 7Li Solid‐State NMR Spectroscopy[J]. Angewandte Chemie International Edition, 2011, 50(52): 12591-12594.
:Goicoechea J M, Sevov S C. Naked deltahedral silicon clusters in solution: Synthesis and characterization of Si93-and Si52-[J]. Journal of the American Chemical Society, 2004, 126(22): 6860-6861.
:Goicoechea J M, Sevov S C. Ligand-Free Deltahedral Clusters of Silicon in Solution: Synthesis, Structure, and Electrochemistry of Si92-[J]. Inorganic chemistry, 2005, 44(8): 2654-2658.
:Schiegerl L J, Karttunen A J, Tillmann J, et al. Charged Si9 clusters in neat solids and the detection of [H2Si9] 2− in solution: a combined NMR, Raman, mass spectrometric, and quantum chemical investigation[J]. Angewandte Chemie International Edition, 2018, 57(39): 12950-12955.
:Lorenz C, Hastreiter F, Hioe J, et al. The structure of [HSi9] 3− in the solid state and its unexpected highly dynamic behavior in solution[J]. Angewandte Chemie International Edition, 2018, 57(39): 12956-12960.
:Hastreiter F, Lorenz C, Hioe J, et al. Elusive Zintl Ions [μ‐HSi4] 3− and [Si5] 2− in Liquid Ammonia: Protonation States, Sites, and Bonding Situation Evaluated by NMR and Theory[J]. Angewandte Chemie, 2019, 131(10): 3165-3169.
:Kysliak O, Schrenk C, Schnepf A. The largest metalloid group 14 cluster, Ge18[Si(SiMe3)3]6: An intermediate on the way to elemental germanium[J]. Angewandte Chemie International Edition, 2016, 55(9): 3216-3219.
:Iwamoto T, Tamura M, Kabuto C, et al. A stable bicyclic compound with two Si= Si double bonds[J]. Science, 2000, 290(5491): 504-506.
:Lee V Y, Sekiguchi A. Aromaticity of group 14 organometallics: Experimental aspects[J]. Angewandte Chemie International Edition, 2007, 46(35): 6596-6620.
:Sekiguchi A, Matsuno T, Ichinohe M. Cyclotetrasilenyl: the first isolable silyl radical[J]. Journal of the American Chemical Society, 2001, 123(49): 12436-12437.
:Sekiguchi A, Matsuno T, Ichinohe M. The homocyclotrisilenylium ion: a free silyl cation in the condensed phase[J]. Journal of the American Chemical Society, 2000, 122(45): 11250-11251.
:Ichinohe M, Matsuno T, Sekiguchi A. Synthesis, Characterization, and Crystal Structure of Cyclotrisilene: A Three‐Membered Ring Compound with a Si− Si Double Bond[J]. Angewandte Chemie International Edition, 1999, 38(15): 2194-2196.
:Margrave J L, Wilson P W. Silicon difluoride, a carbene analog. Its reactions and properties[J]. Accounts of Chemical Research, 1971, 4(4): 145-152.
:Pak C J, Jong U G, Kang C J, et al. First-principles study on the optoelectronic and mechanical properties of all-inorganic lead-free fluoride perovskites ABF 3 (A= Na, K and B= Si, Ge)[J]. Materials Advances, 2023, 4(19): 4528-4536.
:Abersfelder K, White A J P, Rzepa H S, et al. A tricyclic aromatic isomer of hexasilabenzene[J]. science, 2010, 327(5965): 564-566.
:Abersfelder K, White A J P, Berger R J F, et al. A stable derivative of the global minimum on the Si6H6 potential energy surface[J]. Angewandte Chemie International Edition, 2011, 50(34): 7936-7939.
:Sekiguchi A, Yatabe T, Kabuto C, et al.The missing hexasilaprismane: Synthesis, x-ray analysis and photochemical reactions[J]. Journal of the American Chemical Society, 1993, 115(13): 5853-5854.
:Sekiguchi A, Kinjo R, Ichinohe M. A stable compound containing a silicon-silicon triple bond[J]. Science, 2004, 305(5691): 1755-1757.
:Pu L, Twamley B, Power P P. Synthesis and characterization of 2, 6-Trip2H3C6PbPbC6H3-2, 6-Trip2 (Trip= C6H2-2, 4, 6-i-Pr3): a stable heavier group 14 element analogue of an alkyne[J]. Journal of the American Chemical Society, 2000, 122(14): 3524-3525.
:Chen Y, Li J, Zhao Y, et al. Stable radical cation and dication of a 1, 4-disilabenzene[J]. Journal of the American Chemical Society, 2021, 143(5): 2212-2216.
:Sen S S, Jana A, Roesky H W, et al. A Remarkable Base‐Stabilized Bis (silylene) with a Silicon (I)–Silicon (I) Bond[J]. Angewandte Chemie, 2009, 121(45): 8688-8690.
:Wang Y, Xie Y, Wei P, et al. A stable silicon (0) compound with a Si= Si double bond[J]. Science, 2008, 321(5892): 1069-1071.
:Kumai Y, Shirai S, Okamoto H, et al. Properties and Mechanism of Layered Polysilane (Si6H6) Anode[C]//IOP Conference Series: Materials Science and Engineering. IOP Publishing, 2011, 18(12): 122005.
:Keuter J, Schwermann C, Hepp A, et al. A highly unsaturated six-vertex amido-substituted silicon cluster[J]. Chemical Science, 2020, 11(23): 5895-5901.
:Downie C, Tang Z, Guloy A M. An Unprecedented 1∞[Ge9] 2− Polymer: A Link between Molecular Zintl Clusters and Solid‐State Phases[J]. Angewandte Chemie International Edition, 2000, 39(2): 337-340.
丛书类
(1)Chemistry of the Elements (Second Edition), N. N. Greenwood and A.Earnshaw(这本书的中文版称之为《元素化学》,曹庭礼等译,高等教育出版社)
(2)Fuctional Molecular Sillicon Compounds II, D. M. P. Mingos
(3)《无机化学》(第五版),北京师范大学,华中师范大学,南京师范大学合编,高等教育出版社